P Bloku Elementleri ve Özellikleri
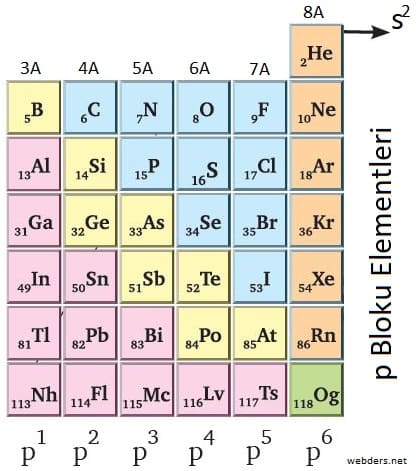
Elektron dizilişleri p orbitaliyle biten elementlere p bloku elementleri denir. Bu elementler periyodik tablonun en sağındaki 6 gruptur. 3A, 4A, 5A, 6A, 7A ve 8A grubu periyodik sistemde p bloku elementlerini oluşturmaktır. Bu elementler A grubunda oldukları için baş grup elementleri sınıfında yer alırlar.
Daha önce s bloku elementlerini görmüştük. S blokunda yer alan elementlerin tamamı metal iken p blokunda metal, ametal ve soy gaz elementler bulunmaktadır. Bu açıdan metal ve ametal karakter önemli bir faktördür.
P Bloku Elementlerinin Periyodik Özellikleri
Kimya dersinde gördüğümüz ametal elementler ve soy gazların tamamı p blokunda yer alır. Ayrıca p blokunda metal elementler de vardır. Şimdi p bloku elementleriyle ilgili temel özellikleri ele alalım.
1. Metal ve Ametal Karakter
P blokunda bulunan elementler içerisinde Al, Ga, In, Tl, Nh, Sn, Pb, Fl, Bi, Mc, Lv, Ts metal elementlerdir. B, Si, Ge, As, Sb, Te, Po, At yarı metal ve C, N, P, O, S, Se, F, Cl, Br, I ametaldir. 8A grubu elementleri (en sağda bulunan grup) soy gazdır.
He (helyum) elementi soy gaz olmasına rağmen değerlik orbitali s2 şeklindedir. Buna rağmen soy gaz olduğu için p blokuna eklenmiştir. Og elementinin metal veya ametal olması ise henüz kesinlik kazanmamıştır.
Periyodik tabloda p bloku içerisinde (soy gazlar dışında) aynı periyotta soldan sağa doğru metalik karakter azalır. Buna karşın ametalik karakter artar. Yine aynı şekilde yukarıdan aşağıya doğru metalik karakter artarken ametalik karakter azalır.
2. İyon Yükü
p blokunde yer alan elementlerin iyon yükü farklılık gösterir. Çünkü bu elementlerden bazıları bileşiklerde çok farklı değerlikler alabilmektedir.
3A grubundaki elementler s2 p1 elektron dizilimi ile sonlanır. Element son s ve p orbitallerindeki 3 değerlik elektronunu vererek çoğunlukla +3 yüklü iyona dönüşür. Aşağıya doğru gittikçe metalik karakter artar. Bu nedenle p orbitalindeki 1 elektronu vererek +1 yük ile yüklenme eğilimi de artar.
4A grubundaki elementler s2 p2 elektron dizilimi ile sonlanır. Elementler p orbitalindeki 2 elektronu vererek +2 ya da 4 değerlik elektronunu vererek +4 iyon yüküne erişebilir. 4A grubunun ilk üyesi olan karbon elementi çok önemli bir ametaldir. Karbon ametal olması sebebiyle 4 elektron alarak oktet kararlılığına erişir. Bu nedenle karbon -4 ile +4 arasında çok çeşitli yüküne sahip olabilir.
5A grubundaki elementler s2 p3 elektron dizilimi ile sonlanır. Elementler p orbitalindeki 3 elektronu vererek +3 ya da 5 değerlik elektronunu vererek +5 iyon yüküne ulaşabilir. Azot (N) ve fosfor (P) ametalleri 3 elektron alarak -3 iyon yükü ile de yüklenebilir.
6A grubundaki elementler elektron s2 p4 dizilimi ile sonlanır. 6A grubunun en bilindik üyesi oksijen (O) elementidir. Bu grubun ametal özelliği güçlü olduğu için 6A grubu elementleri çoğunlukla iki elektron alarak -2 iyon yüküne sahip olur. Grup içerisinde aşağıya inildikçe -4 ve -2 iyon yükleri de görülmektedir.
Oksijen, flor ile yaptığı OF2 bileşiği haricinde hep negatif iyon yüküne sahip olur. Flor daha güçlü bir ametal olduğu için flor ile yaptığı bileşikte ise O2+ şeklinde yüklenir.
7A grubu elementlerinde elektron dizilimi s2 p5 ile biter. Bu grupta 7 değerlik elektronu bulunur ve çoğunlukla -1 iyon yükü yaygın olarak görülür. Bu grubun ilk üyesi olan flor (F) elementi en aktif ametaldir. Bu nedenle bileşiklerinde yalnızca -1 iyon yüküyle yüklenir. Gruptaki diğer elementler ise -1 ile +7 arasında farklı yükler alabilir.
Periyodik tablonun en sağında bulunan soy gazlar helyumu saymazsak s2 p6 dizilimi ile sona erer. Kararlı oldukları için elektron alıp vermez ve tepkimeye girmezler.
3. Aktiflik
Periyodik tabloda sağa doğru gidildikçe ametal karakterin arttığından bahsettik. Öyleyse 7A grubu p blokunun en aktif ametal elementlerini içerir. Grup içerisinde yukarıya doğru (flora doğru) çıktıkça ametal aktiflik artacaktır. 7A grubundaki elementlere halojenler denir. Halojen elementlerin özellikleri daha önceki bir yazıda ele alınmıştı.
Halojen elementlerden astatin elementinin özellikleri tam olarak belirlenememiştir. Diğer elementler tabiatta tuz yapısına katılırlar. Astatin radyoaktif özellik gösterir.
Ametallerden en aktifi şüphesiz flor elementidir. Ametaller kendi aralarında çeşitli kovalent bağlar oluşturur. Ametallerin hidrojenli bileşikleri asit özelliği gösterir. Yine ametal oksitler doğada yaygın olarak bulunurlar.
Yukarıda belirttiğimiz gibi p bloku elementlerinin bazıları metaldir. 3A grubunu incelersek grupta aşağıya doğru inildiğinde metal karakter artış gösterir. Ancak p bloku metallerinin metal karakteri, s bloku elementlerin metal karakterine göre daha zayıftır.
Periyodik tabloda genel olarak sol ve aşağıya gidildikçe atom çapı arttığından iyonlaşma daha kolay hale gelir. Bu nedenle metallerin elektron verme eğilimi de yüksektir. Ametallerde ise elektron alma eğilimi fazladır.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
