Kimyasal Tepkimeler
10. sınıf kimya müfredatının en önemli konularından biri kimyasal tepkimeler konusudur. Kimya bilimi bildiğiniz gibi maddelerdeki dönüşümleri inceler. Bu dönüşümler ise kimyasal tepkimeler ile mümkün olmaktadır. Bu yazıda kimyasal tepkimeler ile ilgili konu anlatımı yapacak ve olabildiğince sizi zorlamadan konuyu öğretmeye çalışacağız.
Maddedeki dönüşümler fiziksel değişimler ve kimyasal değişimler olarak ikiye ayrılır. Fiziksel ve kimyasal değişim yazısında bu ikisinin farklarından bahsettik zaten. Kimyasal değişimler kimyasal tepkimeler ile gerçekleşir.
Kimyasal tepkimelerde maddenin iç yapısı ve kimyasal özellikleri değişir. Bu nedenle kimyasal değişimler fiziksel değişimlere göre daha kapsamlı değişimlerdir. Ayrıca bunların geri dönüştürülmesi de çok zordur.
Kimyasal tepkimeler için en basit örnek suyun oluşumudur. Hidrojen ve oksijen bir araya gelerek su molekülünü oluşturur. Bu olayın denklemi H2 + 1/2O2 → H2O şeklinde ifade edilir.
Kimyasal Tepkimeler ve Özellikleri
Kimyasal tepkime türlerine ve örneklerine geçmeden önce bu tepkimelerin özellikleri üzerinde biraz durmaya çalışalım.
- Kimyasal tepkimeler elementlerin etkileşime geçerek elektron alıp vermeleriyle gerçekleşir.
- Kimyasal reaksiyonların gerçekleşmesi için bazı kimyasal bağların kırılıp yerlerine yeni kimyasal bağların kurulması gerekir.
- Tepkimeler sonucunda maddelerin fiziksel ve kimyasal özellikleri bütünüyle değişir.
- Çevremizde sürekli olarak kimyasal tepkimeler gerçekleşmekte ve bunlar kimyasal değişimlere neden olmaktadır.
- Bir yemeğin çürümesi, mumun yanması, sütün mayalanması gibi durumlar günlük hayattaki kimyasal tepkimelere örnek gösterilebilir.
- Kimyasal tepkimelerde toplam kütle korunur. Toplam atom sayısı da korunur. Ancak mol sayısı değişebilir.
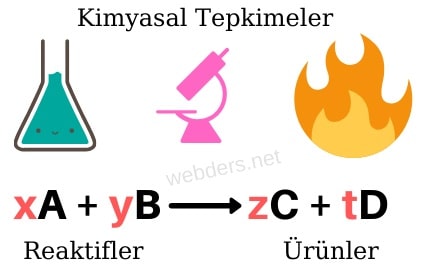
Kimyasal tepkimeleri anlayabilmek için sembollerle gösterdiğimiz elementleri ve bileşikleri kullanırız. Tepkimeye giren maddeler "girenler" ya da "reaktifler" olarak adlandırılırken tepkimeden çıkan maddeler ise "ürünler" olarak adlandırılır. Tepkimenin soluna girenler, sağına ise ürünler yazılır. Arada ise tepkimenin yönünü gösteren ok → konur.
Kimyasal bir tepkime genel olarak Reaktifler → Ürünler şeklinde ifade edilebilir. Başlarda yazılan sayılar katsayıdır ve giren ve ürün miktarlarını gösterir.
CaCO3 + H2SO4 → CaCO3 + CO2 + 2H2O tepkimesinde suyun katsayısı 2'dir. Bu da her 1 molekül reaksiyonda 2 molekül su çıkacağı anlamına gelir. Diğerlerinin katsayısı 1 olduğu için yazılmasına gerek yoktur.
Kimya kanunları gereği giren ve ürünlerdeki atom cinsi ve sayılarının aynı olması gerekir. Bu nedenle denklemde eşitlik sağlanmıyorsa uygun katsayılar yazarak denkleştirme yapmak gerekir. Kimyasal denklemler konusunda denklerim genel özelliklerini ve nasıl denkleştirileceğini anlattık.
Kimyasal Tepkime Türleri
Birçok kimyasal tepkime türü vardır. Çeşitli özelliklere bakılarak bu tepkimeler sınıflandırılabilir. Ancak en yaygın sınıflandırma tekniği giren ve çıkan maddelerin türüne ve değişimine göre yapılan sınıflandırmadır.
En yaygın kimyasal reaksiyon türlerinden biraz bahsedelim.
Yanma Tepkimeleri
Günlük hayatta da şahit olduğumuz yanma aslında yakıcı bir element olan oksijenin tepkimeye girmesidir. Yanmaya aynı zamanda oksitlenme de denir.
Yanma çok hızlı gerçekleştiği zaman ısı çok yükselir ve bazen alev çıkar. Bu tür durumlara hızlı yanma denir. Bazen de yanma ya da diğer adıyla oksitlenme zaman içerisine yayılarak gerçekleşir. Örneğin demirin paslanması bu şekildedir. Bu tür yanmalara ise yavaş yanma denir.
Yanma tepkimelerine aşağıdaki örnekler verilebilir:
- C + O2 → CO2
- H2 + 1/2O2 → H2O
- 2SO2 + O2 → 2SO3
- C2H6 + 7/2O2 → 2CO2 + 3H2O
Analiz (Ayrışma) Tepkimeleri
Bir maddenin daha basit maddelere ayrıldığı tepkimelerdir. Bu tür reaksiyonların gerçekleşmesi için genellikle dışarından ısı (enerji) gerekir.
Analiz tepkimelerine aşağıdaki örnekler verilebilir:
- CaCO3 → CaO + CO2
- 2NaHCO3 → Na2CO3 + CO2 + H2O
- KCIO3 → KCl + 3/2O2
Bazen ayrıştırma işlemi için elektrik enerjisi kullanılır. Bu tür tepkimelere elektroliz adı verilir. Suyun elektrolizi şu şekildedir: H2O → H2 + 1/2O2
Gerçekleşirken ısı alan tepkimelere endotermik tepkime, gerçekleşirken ısı veren tepkimelere ise ekzotermik tepkime denir.
Sentez (Birleşme) Tepkimeleri
Analiz tepkimelerinin tam tersidir. Birden fazla madde bir araya gelerek yeni maddeyi oluşturmaktadır. Sentez tepkimelerinin geneli ekzotermiktir. Yani iki madde birleşip yeni bir madde oluşturduğunda çoğunlukla ısı açığa çıkar.
Birleşme sentez reaksiyonlarına şu örnekler verilebilir:
- N2 + H2 → 2NH3
- H2 + I2 → 2HI
- Fe + S → FeS
- N2 + 3H2 → 2NH3
- K2O + H2O → 2KOH
Bir tepkime bazen iki tür tepkime de olabilir. Örneğin suyun oluşumu (H2 + 1/2O2 → H2O) hem yanma hem de sentez tepkimesidir.
Yer Değiştirme Tepkimeleri
Bazen tepkimelerde bir madde başka bir maddeyle yer değiştirir. Bu tür tepkimelere yer değiştirme tepkimeleri denir.
Yer değiştirme tepkimelerinde esas rol oynayan faktör aktiflik dediğimiz bir kavramdır. Aktifliği fazla olan element küçük olan elementin yerini alarak kendisi tepkimeye girer. Tepkimenin nasıl gerçekleşeceğini bilmek için elementlerin aktiflik kıyasını yapabilmemiz gerekir. Burada çok fazla detaylarına girmeyelim.
Genel olarak hidrojenden daha iyi elektron veren elementler aktif metal, daha zor veren metaller ise soy metal ya da yarı soy metal denir. Cu, Hg ve Ag soy yarı soy metallerdir. Bunlar hidrojenden daha pasif metal özelliği gösterirler. Au ve Pt ise soy metallerdir. Bunlar dışında kalan bütün metaller aktif metal olarak sınıflandırılır ve hidrojenin yerine geçebilirler.
Yer değiştirme tepkimeleri için aşağıdakiler örnek olarak gösterilebilir:
- Zn + CuSO4 → ZnSO4 + Cu (Zn, Cu metaline göre daha aktiftir.)
- CuCl2 + 2Na → 2NaCl + Cu (Na, Cu metaline göre daha aktiftir.)
- K + H2O → KOH + 1/2H2 (K, hidrojene göre daha aktiftir.)
- 2AgBr + Mg → MgBr2 + 2Ag (Br, Ag metaline göre daha aktiftir.)
- NaI + 1/2F2 → NaF + 1/2I2 (F, I'ya göre daha aktif bir ametaldir.)
- CaBr2 + Cl2 → CaCl2 + Br2 (CI, Br'ye göre daha aktif bir ametaldir.)
Yer değiştirme tepkimelerinde aktif olan aktif olmayanın yerini alarak onu dışlar. Kuvvetli metallerin su ile tepkimesinden hidrojen gazı açığa çıkması bu nedenledir.
Nötrleşme Tepkimeleri
Asitler ve bazlar tepkimeye girdiğinde nötr hale gelirler. Asit - baz tepkimelerine başka bir deyişle nötrleşme tepkimeleri denir. Asit ve baz reaksiyonlarından genellikle su ve tuz ortaya çıkar.
Asit + Baz → Tuz + Su şeklinde nötrleşme tepkimeleri genel olarak ifade edilebilir.
Nötrleşme tepkimelerine aşağıdaki örnekler verilebilir:
- HCl + NaOH → NaCl + H2O
- H2SO4 + 2KOH → K2SO4 + 2H2O
- 2CH3COOH + Ca(OH)2 → Ca(CH3COO)3 + 2H2O
- KOH + HCI → KCI + H2O
Bazı durumlarda asit ve bazların kuvveti eşit değildir. Bu durumda ortaya çıkan tuz tam nötr olmaz. Asit kuvvetliyse asidik tuz, baz kuvvetliyse bazik tuz elde edilir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
