Buhar Basıncı Alçalması
Saf maddelerin özellikleriyle karışımların özellikleri birbirinden farklılık gösterir. Karışımların özellikleriyse karışımı oluşturan maddelerin özellikleri ve miktarıyla değişmektedir. Çözeltilerde çözünen miktarına bağlı olarak değişen özelliklere koligatif özellikler denir.
Temel olarak koligatif özellikler dört tanedir.
- Buhar basıncı alçalması
- Donma noktası alçalması
- Kaynama noktası yükselmesi
- Ozmotik basınç
Bu yazıda buhar basıncı alçalması üzerinde duracağız.
Buhar Basıncı Alçalması Neden Olur?
Önce buharlaşma nedir kısaca hatırlayalım.
Buharlaşmanın gerçekleşmesi için moleküllerin kinetik enerjisinin moleküller arası etkileşimleri yenmesi gerekir. Sıvının sıcaklığı arttıkça buharlaşması daha kolay hale gelir.
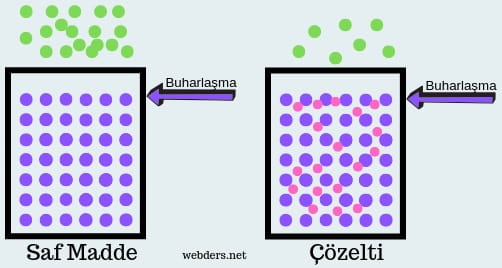
Kapalı bir kap içerisindeki sıvı zamanla buharlaşır. Sıcaklığın artmasıyla buharlaşan molekül sayısı da artış gösterir. Buharlaşan moleküller kapalı ortamda kenarlara çarparak basınç oluşturur. Bu basınca buhar basıncı denir.
Buhar basıncı alçalması çözünen eklendikçe gerçekleşir. Çözünen maddeler sıvı yüzeyinde de bulunur ve sıvıdan gaza geçişi zorlaştırır. Böylece buharlaşma azalır ve buhar basıncı düşer. Çözeltideki çözünen derişimi ne kadar artarsa buhar basıncı da o ölçüde azalır.
Buhar Basıncı Alçalması Formülü
Buhar basıncı alçalması ile derişim arasındaki ilişkiyi Raoult (Rault) Yasası şu şekilde ifade etmektedir:
Çözeltideki çözücünün kısmi buhar basıncı, saf haldeki çözücünün buhar basıncı ile çözücünün mol kesrinin çarpılmasıyla elde edilir.
Pçözücü = Xçözücü.Poçözücü şeklinde elde edilmektedir. Burada Xçözücü çözücünün mol kesri, Poçözücü ise çözücünün saf halinin aynı sıcaklıktaki buhar basıncıdır.
Burada çözeltinin artması demek çözücünün mol kesrinin düşmesi demektir. Formülü anlayabilmek için örnek soruları incelemek gerekir.
Soru: 4,6 gram etil alkolün (C2H5OH) 90 gram su içinde çözünmesiyle hazırlanan çözeltinin 25 °C sıcaklıktaki buhar basıncını hesaplayınız. (Saf suyun 25 °C’taki buhar basıncı: 24 mmHg C2H5OH: 46 g/mol H2O: 18 g/mol)
A) 22,33
B) 23,24
C) 23,52
D) 24,12
E) 25,24
Çözüm: Soruyu çözmek için çözücünün yani suyun mol kesrini bulmak gerekir. Suyun mol sayısı 90 / 18 = 5 mol bulunur. Etil alkolün mol sayısı ise 4,6 / 46 = 0,1 olarak bulunur. Toplam mol sayısı = 5 + 0,1 = 5,1 olur. Suyun mol kesri suyun mol sayısının toplam mol sayısına bölünmesiyle elde edilir. Yani 5 / 5,1 = 0,98 bulunur.
Şimdi formül gereği bu sayıyı saf suyun aynı sıcaklıktaki buhar basıncıyla çarpalım. 0,98x24 = 23,52 mmHg bulunur. Cevap C seçeneğidir.
Görüldüğü gibi alkolün eklenmesiyle buhar basıncı düşmüş yani buhar basıncı alçalması yaşanmıştır.
Koligatif özelliklerden kaynama noktası yükselmesi, donma noktası alçalması ve buhar basıncı alçalması gibi durumlar için formülü ezberleyebilirsiniz. Bunun için benzer örneklerden çözmenizi tavsiye ederiz.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
