London Kuvvetleri
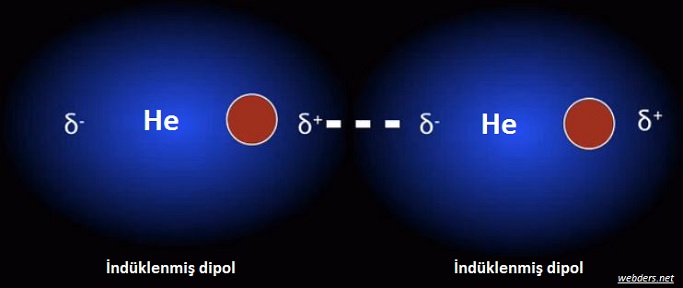
Polar olmayan (apolar) tanecikler arasındaki çekimler zayıftır. Bu taneciklerin birbirine çarpışması sonucu geçici dipoller oluşur. Geçici dipollere indüklenmiş dipol de denir.
London kuvvetleri, birbirine yakın iki atom veya molekül arasında gerçekleşen zayıf bir kuvvettir. Kuvvet, birbirine yaklaştıkça iki atomun veya molekülün elektron bulutları arasındaki elektron etkileşimi tarafından üretilen bir kuantum kuvvetidir.
London Kuvvetleri ve Özellikleri
London kuvvetleri lise kimyasında ve özellikle 10. sınıf müfredatında karşımıza çıkar. Ayrıntı bir konu olarak görüldüğü için de çoğu zaman iyi öğrenilmez. Oysa bu konu oldukça kolaydır. London kuvvetleri hakkında verilen bilgileri ve bu çekim kuvvetinin özellikleri öğrendiğinizde bunu siz de fark edebilirsiniz.
London kuvvetleri He, Ne, H2, F2, CO2 gibi apolar maddelerin geçici dipoller oluşturmasıyla bu dipoller arasında meydana gelen anlık çekimlerdir. Bu nedenle moleküller arasındaki çekimlerin en zayıfı olarak kabul edilirler. Sadece çekim kuvvetleridir. İndiklenmiş dipoller arasında itme kuvvetli yoktur.
Elektron sayısı arttıkça elektron bulutu büyür ve London kuvveti artar. Bu nedenle kaynama noktası da yükselir. London etkileşimlerinin kaynama noktası üzerinde önemli bir etkisi vardır.
Kimyasal türler arası etkileşimler konusu içerisinde anlatılan London kuvvetleri zayıf etkileşimler olarak sınıflandırılır. Ayrıca Van Der Waals bağlarının da bir alt sınıfıdır.
London Kuvvetleri Nasıl Ortaya Çıkar?
Yukarıda bahsettiğimiz gibi bu kuvvetler geçici çekim kuvvetleridir. Bu da apolar maddelerin indüklenmesiyle oluşur. Şimdi bu olayın nasıl gerçekleştiğini daha basit şekliyle anlatalım.
Bir atomun etrafındaki elektronları düşündüğünüzde, atom çekirdeğinin etrafında eşit aralıklarla yerleştirilmiş küçük hareketli noktaları muhtemelen hayal ediyorsunuz. Bununla birlikte, elektronlar her zaman hareket halindedir ve bazen bir atomun bir tarafında diğer tarafa göre daha fazla yoğunlaşırlar.
Bu durum bir atomun etrafında gerçekleşebilir ancak bileşiklerde daha belirgindir. Çünkü elektronlar - yüklüdür ve bağ yapılan diğer atomun + yüklü protonları tarafından da çekilir. İki atomdan gelen elektronlar, geçici (anlık) elektrik dipolleri üretecek şekilde yerleşir. Bu kutuplaşma sonucunda ise çekim oluşur. Kutuplaşma geçiciyse de, atomların ve moleküllerin birbirleriyle etkileşimini etkilemek için yeterlidir.
London Kuvvetleri Hangi Moleküllerde Görülür?
Yukarıda da bahsettiğimiz gibi apolar atom ve moleküller arasında London kuvvetleri görülür. He, Ne, H2, O2, F2, N2, CO2, CH4 gibi atom ve moleküllerin arasında ortaya çıkar ve sonuç olarak bunları bir arada tutar. Çekim kuvvetleri arttıkça bir arada tutma artar ve kaynama noktası yükselir.
Dipolleşme, atomların ve moleküllerin birbirleriyle nasıl bağ kurduklarını etkiler, bu nedenle erime noktası ve kaynama noktası gibi özellikleri de etkiler. Örneğin, eğer Cl2 ve Br2'yi düşünürseniz, iki elementin de benzer şekilde davranmasını bekleyebilirsiniz, çünkü bunlar her ikisi de halojendir. Ancak klor, oda sıcaklığında bir gaz iken, brom bir sıvıdır. Sizce bu neden böyledir? Büyük brom atomları arasındaki London kuvvetleri onları bir sıvı oluşturacak kadar yakınlaştırırken, daha küçük klor atomları arasında daha az çekim vardır. Bu nedenle klorun kaynama noktası daha düşüktür ve oda sıcaklığında gazdır.
London kuvvetleri nelere bağlıdır diye sorarsak şu sonuca ulaşırız: Moleküllerin birbirine yakın olmasına bağlıdır. Çünkü ne kadar yakın ise etkileşim o kadar yüksek olacaktır. İkinci olarak da elektron sayısının yüksek olmasına bağlıdır. Bu durumda elektron bulutu daha büyük olacak ve çekim de artacaktır. Bu nedenle büyük atomlar arasında daha çok London çekimi olur.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
