Kimyasal Türler Arası Etkileşimler
Kimyasal türler arası etkileşimler kimya dersinin önemli bir konusudur.
Evrende bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren en küçük yapı taşı olan bu tanecikler kimyasal tür olarak adlandırılır.
Kimyasal Türler
Kimyasal türler arası etkileşimleri anlayabilmek için kimyasal türleri anlamak gerekir. Temelde 4 tane kimyasal tür vardır. Kimyasal türler;
- Atom
- Molekül
- İyon
- Radikal
olarak sınıflandırılır.
Atom
Elementlerin tüm özelliklerini taşıyan en küçük yapıtaşına atom denir.
Aynı tür atomlardan oluşan maddelere element denir. Bazı atomlar doğada atomları halinde bulunurken, bazıları bileşikleri halinde bulunur. Örneğin soygazlar doğada atomik halde bulunur. Bazı soygaz atomlarının elektron nokta yapıları (Lewis yapıları) aşağıda verilmiştir.

Molekül
En az iki atomun kovalent bağla oluşturdukları atom gruplarına molekül denir.
Aynı tür atomlardan oluşan moleküller, element molekülüdür. Farklı tür atomlardan oluşan moleküller ise bileşik molekülüdür.
Element molekülü: H2, O2, Cl2, Br2, N2, P4,
Bileşik molekülü: H2O, CO2, CH4, NH4, NH3,
İyon
Herhangi bir atom elektron kaybettiğinde pozitif yüklenerek katyon iyonunu oluşturur. Eğer atom elektron kazanırsa negatif yüklenir ve anyon iyonu haline gelir. İki çeşit iyon vardır. Tek atomlu ve poli atomlu.
Tek atomlu: Mg+2, F-1, Na+1
Poli atomlu: OH-, NH4, S04-2
Radikal
Ortaklanmamış elektron bulunduran taneciklere radikal denir. Radikaller yüksek enerjili ve kararsız ara ürünlerdir. Kararsız oldukları için kimyasal tepkimelere girme istekleri oldukça yüksektir.
Formüllerinin üzerine nokta"." konularak gösterilirler. Serbest radikaller tek atomlu olabildiği gibi birden çok atom içeren atom grupları da olabilirler.
Kimyasal Bağların Oluşum Mekanizması
Kimyasal bağlar kimyasal türler arası etkileşimler aracılığıyla meydana gelirler.
Atomlar arasında kimyasal bağ oluşacağı zaman atom çekirdeğine en uzakta bulunan elektronlar (değerlik elektronları) etkileşir.
Bir atomun dış katmanındaki elektronlarına değerlik elektronları denir.
Birbirinden bağımsız iki (farklı ya da aynı) kimyasal tür birbirine yaklaştığında elektron bulutları ve çekirdekleri arasında elektrostatik çekim meydana gelir. Elektrostatik çekim sayesinde çekme ve itme kuvvetleri meydana gelir.
İki atom birbirine yaklaştığında çeşitli İtme ve çekme kuvvetleri oluşur.
Buradaki kuvvetler için;
Pozitif yükler (çekirdekler) birbirini İter.
Negatif yükler (elektronlar) birbirini İter.
Çekirdekler (pozitif yükleri) diğer kimyasal türün elektronlarını çeker.
Kimyasal türler arasında gerçekleşen etkileşimler karşılaştırıldığında çekme kuvvetleri itme kuvvetlerinden çok büyükse güçlü etkileşimler yani kimyasal bağlar oluşur. Çekme kuvvetleri itme kuvvetlerinden biraz büyükse zayıf etkileşimler yani fiziksel bağlar oluşur.
Bağ Enerjisi
İki atomlu bir gaz molekülünü nötral atomlarına ayrıştırmak İçin gereken enerji bağ enerjisi olarak adlandırılır.
O2(g)+ 145 kJ.mol-1 → O(g) + O(g)
H2(g)+ 436 kJ.mol-1 → H(g) + H(g)
O2 molekülünün O atomlarına ayrışması için mol başına 145 kJ lük enerji gerekirken, H2 molekülünü atomlarına ayrıştırmak için mol başına 436 kJ lük enerji vermemiz gerekir. Buna göre, H2 molekülleri 02 moleküllerinden daha kararlıdır.
H2O(s) + 43,9 kJ.mol-1 → H2O(g)
Verilen örneklerden de görüldüğü gibi kimyasal türleri birbirinden ayırmak için enerji gereklidir.
Kimyasal türleri birbirinden ayırmak için gereken enerji 40.kJ.mol-1 veya daha fazla İse bu türler arasındaki etkileşim güçlü etkileşim (kimyasal bağ) olarak kabul edilir.
Kimyasal türleri birbirinden ayırmak için 40 kJ.mol-1 den daha az enerji gerekiyorsa türler arasında zayıf etkileşim (fiziksel bağ) meydana gelir.
Bağlar oluştuğunda veya koptuğunda farklı kimlikte yeni kimyasal türler meydana geldiğinde enerji değişimi yüksek olur. Hal değişimi ve çözünme gibi fiziksel bağların rol aldığı değişimlerde İse maddelerin kimliğinde bir değişim olmaz, bu nedenle enerji değişimi daha küçük olur.
Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması
Kimyasal türler arası etkileşimler önce güçlü ve zayıf etkileşimler olarak ikiye ayrılır. Sonra bu etkileşimler de kendi alt başlıkları arasında türlere ayrılır.
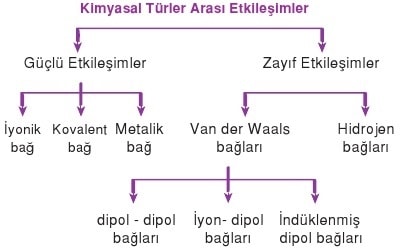
Kimyasal türler arası etkileşimler tablo olarak iyi sınıflandırılırsa konuyu anlamak çok daha kolay olur.
Güçlü Etkileşimler
Kimyasal türler arasında oluşan güçlü etkileşimler üç tanedir.
- İyonik bağ
- Kovalent bağ
- Metalik bağ
Bu bağlar kimyasal türler arası etkileşimler içerisinde en güçlü olanlarıdır.
İyonik Bağ
Kimyasal türler arası etkileşimler içindeki ilk etkileşimdir. Elektronegatiflikleri çok farklı olan atomlar arasında elektron alış verişinin tam olduğu ve sonuçta iyonların oluştuğu varsayılır. Elektron kaybeden pozitif iyon, elektron alan ise negatif iyon olur. İyonik bağ ise pozitif ve negatif iyonların arasındaki elektrostatik çekme kuvvetidir.
NaCl bileşiği iyonik bağ için iyi bir örnektir.
Na atomu Na+ iyonuna dönüştüğünde oktete uymuştur.
Cl atomu CI- iyonuna dönüştüğünde oktete uymuştur.
İyonlar arasında iyonik bağlı Na+ CI- ya da NaCI bileşiği oluşur.
İyonik Bağların Sağlamlığı
İyonik bağlı bileşiklerde iyonik bağın sağlamlığı iyon yarıçaplarına ve iyon yüklerine göre yorumlanabilir.
İyon yarıçapı arttıkça, elektrostatik çekim gücü azalır.
İyon yükü arttıkça çekim gücü artar ve iyonik bağın kuvveti artar.
Örneğin, NaF, NaCI, NaBr ve Nal bileşiklerindeki iyonik bağların sağlamlığını karşılaştırmak için bileşiklerdeki iyonlar arası uzaklıklara bakılabilir.
İyon yarıçapları I- > Br- > Cl- > F- şeklindedir.
İyonların çekirdekleri arasındaki uzaklık azaldıkça iyonik bağ daha sağlam hale gelir. Böylece erime noktası yükselir.
İyonlar arası uzaklık:
Nal > NaBr > NaCI > NaF şeklindedir.
İyonik bağın sağlamlığı:
NaF > NaCI > NaBr > Nal şeklindedir.
Bileşiklerin erime noktaları:
NaF > NaCI > NaBr > Nal şeklindedir.
Örneğin, CaO ve CaCI2 bileşiklerindeki iyonik bağların sağlamlığını karşılaştırmak için iyonların yüklerine bakılabilir.
Coulomb kanununa göre yüklerin büyüklüğü arttıkça, elektrostatik çekim kuvveti artar.
CaO katısındaki anyonun yükü (O-2), CaCI2'deki anyonun yükünden (Cl-) daha büyüktür. Dolayısıyla elektrostatik çekim kuvveti CaO katısında daha büyüktür. Bunun sonucu olarak iyonik bağ CaO'de daha sağlamdır, erime noktası da daha yüksektir.
İyonik Bağlı Bileşiklerin Özellikleri
İyonik bağlı bileşikler zıt yüklü iyonların bir araya gelmesiyle oluşan elektrostatik çekim kuvveti olduğundan, erime ve kaynama noktaları yüksektir.
İyonik bileşiklerin katı halleri sert ve kırılgandır. İyonik katı üzerine çekiçle vurulduğunda iyonik kristalin düzenli yapısı bozulur ve kırılma olayı gerçekleşir. Bu yüzden iyonik katılar çekiçle dövülerek şekillendirilemez.
İyonik bağlı katılarda iyonlar hareket etmediği için elektrik akımını iletmezler.
İyonik katılar suda çözündüğünde sulu çözeltilerine iyonlarını verirler, böylelikle oluşan çözelti elektrik akımını iletir. (Elektrolit çözelti oluşur.)
İyonik katılar sıvı hale dönüştüğünde elektrik akımını iletir.
Kovalent Bağ
Daha kararlı hale gelebilmek için iki atom arasında iki veya daha fazla elektronun ortaklaşa kullanılması ile oluşan kimyasal bağlara kovalent bağ denir. Oluşan bileşiklere ise kovalent bağlı bileşikler denir. Kovalent bağlı moleküllerin oluşması için kullanılan elementlerin ametal olması gerekir. H2, O2, CO2, H2O, NH3, CH4, C2H6 gibi moleküller kovalent bağlıdır.
Kovalent Bağlarda Orbital Örtüşmesi
Kimyasal türler arası etkileşimler kovalent bağa neden oluyorsa bu durumda orbital örtüşmesi gerçekleşir.
s - s orbitalleri örtüşmesi
Örneğin H2 molekülünün oluşumu (H atomları arasında oluşan güçlü etkileşim) (kimyasal bağ oluşumu) aşağıda gösterilmiştir.
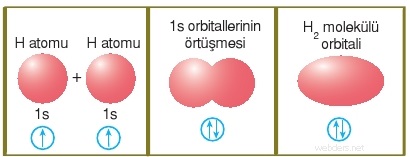
1H: 1 s1 elektron dizilimine göre iki hidrojen atomu birbirine yaklaştığında 1s orbitalleri birbirinin içine geçmeye başlar. Bu olaya orbitallerin örtüşmesi denir.
Hidrojen atomundaki 1s orbitallerinin örtüşmesi orbital şemaları ile gösterelim.
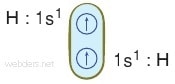
Şekilde de hidrojen atomunda s örtüşmesi gösterilmiştir. Burada çekirdekler arasında negatif yüklü elektron yoğunluğu artışı olur ve çekim kuvveti artar. H atomları arasında kovalent bağ oluşur.
s - p ve p - p orbitalleri örtüşmesi
Kovalent bağ oluşumunda sadece s orbitalleri örtüşmez. Diğer orbitaller de kendi aralarında ve diğer orbitallerle örtüşebilir. s - p ve p - p orbital örnekleri aşağıda gösterilmiştir.
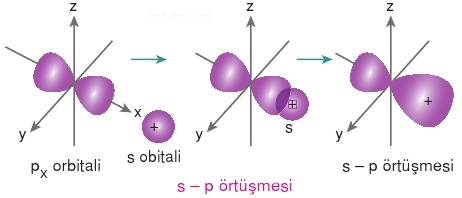
Yukarıda s-p örtüşmesi gösterilmiştir. p-p örtüşmesi de aşağıdadır.
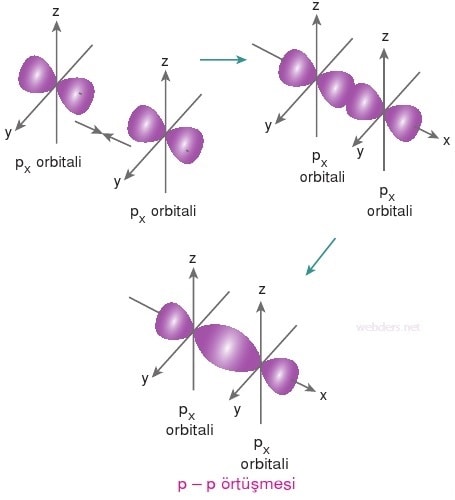
Hidrojen dışındaki kararsız atomlar oktede ulaşana kadar kovalent bağ oluşturabilirler. Bu bağ oluşumlarında s orbitalleri örtüşebileceği gibi farklı orbitaller de birbiriyle örtüşebilir.
Örneğin, HCI molekülünde bir tane s - p örtüşmesi olur.
Cl2 molekülünde ise Cl molekülleri arasında p - p örtüşmesi olur. Böylece Cl atomları oktedini tamamlar ve kararlı hale gelir.
Kimyasal Bağların İyonik ve Kovalent Karakteri
Kimyasal bağlar hem iyonik bağın hem de kovalent bağın özelliklerini taşır.
Kimyasal bağlarda elektronlar elektronegatifliği yüksek olan atomun çekirdeği tarafından daha kuvvetli çekilir.
Bir atomun kimyasal bağdaki elektronları kendine çekme yeteneğinin ölçüsüne elektronegatiflik denir.
Örnek olarak HF molekülünü inceleyelim. Burada H’nin elektronegatifliği 2,1 F'nin elektronegatifliği ise 4,0’dır. Sonuç olarak ortaklaşa elektronlar F atomuna daha yakın olur.
Buna göre, F atomunun çekirdeği ortaklaşa kullanılan elektronları daha güçlü çeker. Bunun sonucunda H atomu F atomuna elektronunu vermiş gibi davranır ve H atomu geçici olarak (+) ile yüklenirken F atomu ise (-) ile yüklenir.
Bir kimyasal bağdaki elektronlar % 100 bağdaki bir atoma ait olamaz. Çünkü bu elektronlar her iki atom tarafından az ya da çok çekilir. Dolayısıyla bir kimyasal bağ ne kadar iyonik olursa olsun mutlaka kovalent karakter taşır. Yani % 100 iyonik bağ yoktur.
İki atom arasındaki elektronegatiflik farkı sıfırsa, oluşan bağ % 100 kovalenttir. Örneğin H2 molekülünde H atomları arasındaki kimyasal bağ % 100 kovalenttir. Çünkü hidrojen atomları arasındaki elektronegatiflik farkı (2,1 - 2,1 = 0) sıfırdır.
İyonik bağlı bileşiklerin atomları arasındaki elektronegatiflikleri farkı büyüktür.
Kovalent bağlı bileşiklerin atomları arasındaki elektronegatiflik farkı küçüktür.
Bu nedenle farklı atomlar arasındaki bağların iyonik veya kovalent karakterleri elektronegatifliklerine bakılarak karşılaştırılabilir.
Kovalent Bağların Polarlığı
Bir kimyasal bağın polarlığını, bağı oluşturan atomların elektronegatiflik değerleri belirler.
Elektronegatiflik değerleri eşit olan atomlar arasında elektronegatiflik farkı sıfır olacağından oluşan kovalent bağlara apolar kovalent bağ denir. Buna göre, aynı ametal atomları arasında oluşan H - H, Cl - Cl, O = O kovalent bağlar apolardır.
Elektronegatiflik değerleri farklı atomlar arasında oluşan kovalent bağlara polar kovalent bağ denir. Kovalent bağdaki elektron çiftine atomlar elektronegatiflik değerlerine göre çekim uygular. Dolayısıyla bağ elektronları elektronegatiflik değeri büyük olan atoma doğru daha fazla yaklaşır.
Bunun sonucu olarak bu atomda negatif yük yoğunluğu artar, yani atom kısmi negatif yükle yüklenir. Elektronegatifliği küçük olan atomda ise elektronun uzaklaşmasından dolayı elektron yoğunluğu azalır. Böylece atom kısmi pozitif yükle yüklenir.
Sonuç olarak bağın bir tarafında pozitif, diğer tarafında negatif yük oluşur. Bu tür pozitif ve negatif kutup oluşturan kovalent bağlar polar kovalent bağ olarak adlandırılır.
HF molekülünde florun elektronegatifliği hidrojenkinden yüksek olduğundan ortaklaşa kullanılan elektronları kendine daha çok çeker. Böylelikle F de kısmi negatif hidrojende ise kısmi pozitif yük oluşur.
Kovalent Ağ Örgüsü
Karbonun allotropları olan elmas, grafitin ve silisyum gibi katıların erime noktaları çok yüksektir. Çünkü bu katıların tanecikleri arasında ağ örgülü kovalent yapı vardır.
Elmas ve grafit oda koşullarında katı haldedir. Grafit yumuşak, elmas ise çok serttir. Grafit elektrik akımını iletir, ışığı geçirmez. Elmas ise elektriği iletmez, ışığı geçirir. Bu özelliklerinin farklı olmasının nedeni taneciklerin ağ örgüsü yapılarının farklı olmasındandır.
Metalik Bağ
Metal atomlarının gevşek bağlı değerlik elektronları vardır. Bu elektronlar diğer metal atomlarında bulunan eş enerjili boş değerlik orbitalleri arasında gezinir. Bu şekilde çok sayıda elektronların metal atomları arasında gezinmesiyle bir elektron denizi oluşur. Bu arada elektron kaybeden atomlar pozitif yüklü iyon haline gelir.
Pozitif yüklü metal iyonları ile elektron denizi arasında elektrostatik çekim kuvveti meydana gelir. Bu çekim kuvveti metalik bağ olarak adlandırılır. Metalik bağ atomlarının bir arada durmasını sağlar.
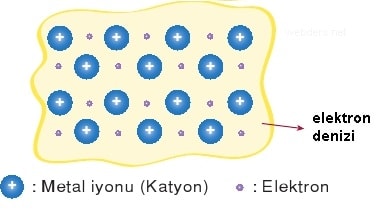
Gevşek değerlik elektronlarının oluşturduğu elektron denizi ile metal katyonları arasında oluşan çekim metalik bağdır. Metal atomları metalik bağla bir araya gelerek kristal yapı oluşturur.
Metalik bağda ortamda hareket eden değerlik elektronları ve değerlik elektronlarını vermiş gibi olan metal katyonu vardır. Metalik bağda pozitif ve negatif yük sayısı birbirine eşittir. Metalik kristalin örgü yapısında değerlik elektronlarının serbestçe dolaşabilmesi metalik bağın iyonik ve kovalent bağlardan farklı olmasına sebep olur. Elementler içerisinde metallerin en önemli özelliklerinden birisi elektrik akımını ve ısıyı iyi iletebilmeleridir. Bununla birlikte metallere has başka özellikler de bulunur.
Metallerin Bazı Özellikleri
Kimyasal türler arası etkileşimler sonucunda metallerin çeşitli özellikleri ortaya çıkar. Metallerin özelliklerine bu konu çerçevesinden bakabiliriz.
Tel ve Levha Haline Getirebilme
Metallerin yapısında bir elektron denizi bulunduğu için dışarıdan bir darbe uygulandığında; örneğin çekiçle dövülerek ya da çekilerek metallere şekil vermek mümkündür.
Metallerin Elektrik iletkenliği
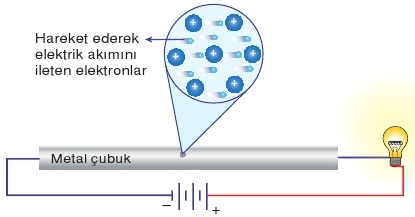
Elektrik akımı çözeltilerde iyonlar, katı maddelerde ise elektron akışıyla gerçekleşir. Serbest hareket edebilen elektronlar olduğu için metaller elektrik akımını iletir. Metaller elektrik iletkenliği açısından kıyaslandığında iyonik ve kovalent bağlı bileşiklere göre oldukça yüksek iletkenliğe sahiptirler.
Bir metal çubuğa elektriksel gerilim uygulandığında serbest değerlik elektronları hareket ederek bir elektrik akımı oluştururlar. Bu elektron akımı elektriğin iletilmesini sağlar.
Metalik Parlaklık
Metallerin yüzeyi parlaktır. Çünkü metalin yüzeyine çarpan ışık ışınları metalde serbest hareket eden değerlik elektronlarına enerji aktarır. Enerji alan elektronlar daha yüksek enerji katmanına uyarılır. Bir süre sonra bu elektronlar tekrar temel hale döndüklerinde aldıkları enerjinin tamamını ışın olarak dışarı verirler. Bu da metallerin parlak görünmesine neden olur. Yani metaller gelen ışığı yansıttığı için parlak görünür.
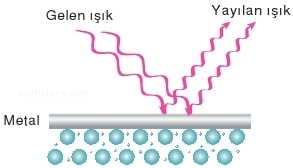
Metal atomları gelen ışının tamamını veya bir kısmını yansıtır. Bu nedenle metalik parlaklığa (bazıları renge) sahiptir.
Metallerin Sertliği
Bir maddenin tanecikleri arasındaki bağ ne kadar kuvvetli ise maddenin erime noktası da o kadar yüksektir. Bu nedenle metalik bağ ne kadar güçlü olursa metalin erime noktası da o kadar yüksek olur. Yani diğer bir deyişle metal o kadar sert olur.
Metal atomundan elektron denizine bırakılan elektron sayısı arttıkça metal çevresindeki negatif yük yoğunluğu da artar. Aynı zamanda metalin pozitif yük miktarı da artar.
Bunun sonucu olarak metal çekirdekleri ile elektron denizi arasındaki elektrostatik çekim kuvveti de artar. Böylece metalik bağ kuvveti artar, erime noktası ve metalin sertliği artar.
Bir grupta aşağı doğru indikçe çap büyüdüğünden metal bağı zayıflar, erime noktası düşer.
Bir periyotta sağa doğru gittikçe, çap küçüldüğünden metal bağının kuvveti artar, erime noktası yükselir.
Geçiş metallerindeki bağ metalik karakterlerle birlikte kovalent karakter de taşır. Çünkü yarıdolu d orbitalleri birbiriyle örtüşerek bağa kovalent karakter kazandırır. Dolayısıyla metalde ne kadar çok yarı dolu d orbitali varsa bağ o kadar çok kovalent karakter içerir. Bu da metalik bağdaki kovalent karakterlerle beraber metalin erime noktası ve sertliğinde artışa neden olur.
Zayıf Etkileşimler
Kimyasal türler arası etkileşimler içinde daha güçsüz olanları zayıf etkileşimler olarak adlandırırız. Zayıf etkileşimler (fiziksel bağlar) maddelerin yoğun fazlarında (sıvı ve katı halde) etkilidir. Bu tür bağların kuvveti sıcaklığa bağlıdır. Sıcaklık değiştikçe tanecikler arasındaki etkileşimin kuvveti değişir, maddenin fiziksel hali değişir. Ancak maddenin kimyasal türü değişmez. Bundan dolayı bu tür değişimler fiziksel olaylardır.
Dipol
Kimyasal türlerde elektron yoğunluğunun fazla olduğu yer negatif kutup, elektron yoğunluğunun az olduğu yer pozitif kutup olarak adlandırılır. Bir kimyasal tür pozitif ve negatif kutup bulunduruyorsa yani elektron yük yoğunluğu eşit dağılmamış bir yapı içeriyorsa iki kutuplu anlamına gelen dipol terimi kullanılır.
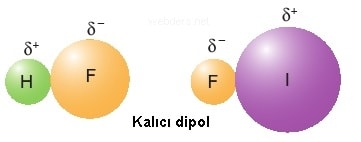
Bazı türler kalıcı dipole sahipken, bazı türler geçici (anlık) dipol içerirler.
Kalıcı dipoller: HF, HCI, HBr gibi moleküllerdeki atomların elektronegatiflikleri farklıdır. Bu yüzden moleküller polar moleküllerdir. Bu moleküllerde atomların birinde negatif yük yoğunluğu diğerinde ise pozitif yük yoğunluğu bulunur. Bunlar kalıcı dipol karakter oluşturur.
Bu kutuplar bağ kopmadığı sürece korunur. Bu nedenle polar kovalent bağ yapmış iki atomlu moleküller kalıcı dipole sahiptir. Örneğin HCI, HF ve Hl gibi moleküller kalıcı dipole sahiptir.
Elektronegatiflikleri farklı iki atom arasındaki kovalent bağ polardır. Bu tür iki atomlu moleküller kalıcı dipole sahiptir.
Elektronegatiflik farkı sıfır olduğundan H2, O2 ve F2 gibi moleküllerde elektron yük yoğunluğu eşit dağılmıştır. Negatif ve pozitif kutuplar yoktur. Bu nedenle bu tür moleküllerde kalıcı dipol bulunmaz.
Tek başına bulunan bir atomda da elektron yük yoğunluğu eşit dağılmıştır. Bu nedenle atomik halde bulunan He, Ne ve Ar gibi soygaz atomlarında da kalıcı dipol yoktur.
Polar kovalent bağ içeren ve ikiden fazla atomdan oluşan moleküllerin polar olup olmadığını anlayabilmek için molekülün geometrisi bilinmelidir. Örneğin, atomlar arası polar kovalent bağ olan ve tüm atomları aynı düzlemde bulunan C02 ve BF3 molekülleri kalıcı dipole sahip değildir.
Su molekülünde atomlar aynı düzlemde olmasına rağmen elektron yük yoğunluğu oksijen üzerinde oluşmakta ve pozitif yük yoğunluğu hidrojenler tarafında meydana gelmektedir.
Polar kovalent bağ içermesine rağmen CO2 ve BeF3 molekülleri apolardır. Dolayısıyla bu moleküllerde kalıcı dipol yoktur.
CO2 molekülünde kısmi negatif yükler (elektron yoğunluğu) doğrusal ve zıt yönde olduğu için birbirini nötrler ve dipol oluşturmaz. Benzer şekilde BeF3 molekülünde de kısmi negatif yükler aynı düzlemde ve eşkenar üçgen oluşturur. Bu nedenle birbirinin etkisini yok eder ve molekül apolar yapıya sahip olur. Dolayısıyla molekülde bir kutuplaşma yani kalıcı dipol oluşmaz.
Su molekülünde atomlar aynı düzlemde olmasına rağmen elektron yük yoğunluğu oksijen üzerinde oluşmakta ve pozitif yük yoğunluğu hidrojenler tarafında meydana gelmektedir.
Bu şekilde H2O da iki zıt kutup bulunduğundan molekül polardır ve kalıcı dipole sahiptir. Benzer şekilde SO2 ve OF2 moleküllerinde de kalıcı dipol oluşur.
Geçici (İndüklenmiş) dipoller: Aynı atomlardan oluşan H2, F2, Cl2, N2 gibi moleküller ve He, Ne, Ar gibi soygazlarda elektron dağılımı eşittir. Böyle maddelere apolar denir. Bu türlerde kalıcı dipoller oluşmaz.
Ancak apolar yapılar polar yapı kazanabilir. Bunun için elektronların ait olduğu atomun veya molekülün bir bölgesine yığılması gerekir. Bu yığılma dışarıdan yapılan bir etkiyle oluşuyorsa ortaya çıkan dipole indüklenmiş dipol denir.
Apolar bir tanecikte ne kadar çok elektron varsa indüklenmiş dipolün polaritesi o kadar büyük olur.
Kimyasal türler arası etkileşimler zayıf etkileşimse Wan der Waals ya da hidrojen bağı vardır.
Van Der Waals Bağları
Kalıcı dipol ve indüklenmiş dipole sahip olan kimyasal türlerin kendi aralarında ve diğer türler ile yaptığı her türlü fiziksel bağ (hidrojen bağı hariç) Van der waals bağıdır.
Dipol - dipol Bağları: Polar moleküller arasında oluşan bağ türüdür. İki polar molekül birbirine yaklaşırken birinin pozitif kutbu ile diğerinin negatif kutbu arasında oluşan elektrostatik çekmelere dipol - dipol kuvvetleri denir.
Dipol - dipol bağlarında sadece çekme kuvvetleri yoktur, benzer yükler arasında itme kuvvetlerinde vardır. Bu da oluşan bağı zayıflatır, taneciklerin düzenli bir şekilde bir araya gelmelerini engeller.
Dipol - dipol kuvvetleri HCI, Hl gibi maddelerin yoğun fazlarında görülen ya da bu tür maddelerin birbiri içinde çözünmesi sırasında oluşan kuvvet türüdür. Bu nedenle polar yapıya sahip moleküller birbiri içinde çözünebilir. Örneğin etil alkolün (C2H5OH) su içerisinde çözünmesinde her iki molekülün de polar yapıya sahip olması önemli bir etkendir.
İyon - Dipol Bağları: Bir iyonun polar bir molekül ile etkileşmesi sırasında oluşan bağ türüdür. Katyonlar molekülün negatif kutbu ile anyonlar ile molekülün pozitif kutbu ile etkileşir.
Yemek tuzunun (NaCI) suda çözünmesi olayında tanecikler arasında oluşan etkileşim iyon - dipol bağıdır.
NaCI kristalleri suya atıldığında polar su moleküllerinin negatif kutbu Na+ katyonlarına pozitif kutbu Cl- iyonlarına yaklaşır ve iyonlar kristal örgüden koparak su içerisinde dağılırlar.
İndüklenmiş (Geçici) Dipoller Arasındaki Bağlar (London Kuvvetleri): Polar olmayan He, Ne, H2, O2, CO2 gibi tanecikler arasında çekim kuvvetleri oldukça zayıftır. Bu taneciklerin birbiri ile çarpışması sonucunda geçici dipoller oluşur. Geçici dipoller sayesinde N2, CO2, CH4 gibi apolar moleküller sıvı hatta katı hale geçebilirler.
İndüklenmiş dipol - indüklenmiş dipol kuvvetlerine London kuvvetleri de denir. Bu kuvvetler ilk kez Fritz London tarafından açıklanmıştır.
Anlık sürelerde gerçekleştiği için London kuvvetleri moleküller arası etkileşimlerin en zayıfı olarak kabul edilir. Apolar moleküller arasında yalnızca London kuvvetleri bulunur.
Kaynama Noktası ve London Kuvvetleri
London kuvvetleri elektron hareketliliğine bağlı olduğu için elektron sayısı arttıkça etkileşimler de artar. Bunun sonucu olarak da kaynama noktası artar.
Molekül formülleri aynı fakat uzaydaki dizilişleri farklı bileşiklere izomer denir.
İzomer moleküllerden doğrusal yapılı olanların indüklenmiş dipol potansiyeli küresel olanlara göre daha büyük olur. Bu nedenle bu tür moleküllerin London kuvvetleri daha güçlü olur. Bunun sonucu olarak erime ve kaynama noktaları daha yüksektir.
Örneğin CCI4 sıvısında yemek tuzunun (NaCI) çözünmesi ile iyon - indüklenmiş dipol etkileşimi meydana gelir.
Dipol - İndüklenmiş Dipol Etkileşimi: Polar maddelerin dipolleri ile apolar maddelerin indüklenmiş dipolleri arasında anlık oluşan kuvvetlere dipol - indüklenmiş dipol etkileşimi denir.
Dipol - indüklenmiş dipol bağları dipol - dipol bağlarını koparacak kadar kuvvetli değildir. Bu nedenle polar maddeler ile apolar maddelerin birbiri içindeki çözünürlüğü yok denecek kadar azdır. Örneğin apolar l2 molekülleri polar H2O da çözünmez, ancak apolar CCI4 de iyi çözünür.
İndüklenmiş Dipol - İndüklenmiş Dipol Etkileşimi: Aynı veya farklı apolar taneciklerin geçici dipolleşmesi sonucu aralarında oluşan elektrostatik çekim kuvvetleri indüklenmiş dipol - indüklenmiş dipol etkileşimidir.
Apolar maddeler birbiri içerisinde genellikle iyi çözünür. Örneğin apolar l2 katısı apolar CCI4 sıvısında çözünür.
Hidrojen Bağları
Hidrojen bağının oluşabilmesi için hidrojenin molekülde bulunması gerekir.
Hidrojen bağı Van der Waals bağları ile kıyaslandığında, hidrojen bağları yaklaşık olarak 10 kat daha güçlüdür.
Hidrojen bağı oluşturan maddeler birbiri içinde daha iyi çözünür. Örneğin etilalkol (C2H5OH) su molekülleriyle dipol - dipol bağlarının yanında hidrojen bağları da oluşturur. Bu yüzden etil alkol suda çok iyi çözünür.
Çok sayıda hidrojen bağı oluşturabilen bazı moleküllerin arasındaki fiziksel bağlar atomlar arası kovalent bağlardan daha kuvvetli olabilir. Örneğin glikoz bir kapta ısıtıldığında erimeye başlamadan önce molekül yapısı bozulur. Çünkü çok sayıda hidrojen bağı yapan şeker molekülleri arasındaki fiziksel bağ o kadar kuvvetlidir ki, bu bağlar kopmadan moleküldeki kovalent bağlar kopar. Bu nedenle ısıtılan şeker önce karamelleşir ısıtılmaya devam edildiğinde ise kömürleşir.
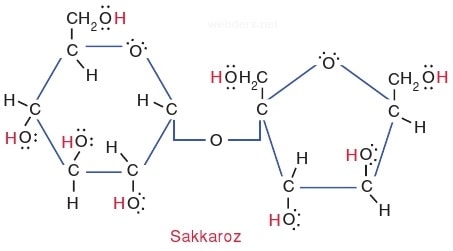
Sakkaroz molekülünde bulunan OH yapısındaki hidrojenler çok sayıda hidrojen bağı yapar. Bu nedenle moleküller arası fiziksel bağ, atomlar arasındaki kovalent bağdan daha güçlü olur.
Ayrıntıları ile yazmanız soru çözerken çok yararlı oluyor. Cümlelerde çok anlaşılır, kafa karıştırmıyor. Çok teşekkürler emekleriniz için..
