Gazlar
Maddenin akışkan hallerinden biri de gaz halidir. Gazlar konusunda maddenin gaz hali incelenir. Gazlar konuldukları kabı doldurmak üzere genişleyen, bastırıldıklarında çok küçük hacimlere kadar sıkıştırılabilen akışkanlardır. Bu konuda; hacim, sıcaklık, mol sayısının değişmesiyle gaz fazındaki taneciklerin davranışları incelenecektir.
Gazların Özellikleri
İçinde bulundukları kabın hacmini ve şeklini alırlar.
Yoğunlukları sıvılardan ve katılardan daha azdır. Boşluklu yapıya sahiptirler. Bulundukları kaba homojen dağıldıklarından her tarafa aynı basıncı uygularlar.
Birbirleriyle her oranda homojen karışım oluşturabilir. Gaz tanecikleri arasındaki boşluk oldukça büyük olduğundan gazlar sıkıştırılabilirler.
Sıcaklığın artmasıyla gazların hacimlerinde meydana gelen değişime "ısıl genleşme" denir. Bir gaz molekülünün ortalama olarak iki çarpışma arası aldığı yola ortalama serbest yol denir.
Tüm gazların genleşme katsayıları aynı olup, genleşme katsayısı gazlar için ayırt edici değildir.
Gazlarda Kinetik Teori ve Difüzyon
Gazların davranışlarını açıklamak için 19. yüzyılda Maxwell ve Boltzman gazların kinetik teorisini ortaya koymuştur.
Kinetik Teori
Gazların katı ve sıvılardan farklı olan davranışlarını ve gaz taneciklerinin arasındaki boşlukları ve etkileşimleri açıklar. Kinetik teoriye göre;
- Gaz molekülleri arasındaki mesafeler yanında, moleküllerin boyutları ihmal edilebilir. (Sıfır kabul edilebilir.)
- Gaz molekülleri arasındaki itme ve çekme kuvvetleri ihmal edilir.
- Aynı sıcaklıkta farklı gazların ortalama kinetik enerjileri de aynıdır.
- Gaz tanecikleri kap içerisinde gelişi güzel hareket ederler. Bu esnada birbirleriyle ve kabın çeperleriyle esnek çarpışmalar yaparlar. Çarpışma sırasında sistemin toplam kinetik enerjisi sabit kalmaktadır. Ancak hareket yönleri değişir.
- Gaz tanecikleri her yöne doğru sürekli, hızlı ve doğrusal hareket yaparlar.
Bu varsayımlar ideal gaz tanımının temeli olup bu varsayımlara ihmal edilebilir farklarla uyan gazları ideale yakın gaz şeklinde nitelendirebiliriz. O halde ideal gazı şöyle tanımlayabiliriz;
Molekülleri arasında itme ve çekme kuvveti olmayan, kendi hacimleri kabın hacmi yanında ihmal edilebilen gazlara ideal gaz denir.
Gerçekte böyle bir gaz yoktur; ancak bazı koşullarda idealliğe yakın davranan gaz vardır. Gazlar yüksek sıcaklık ve düşük basınçta birbirlerinden oldukça uzaklaşırlar ve moleküller arası etkileşim en aza iner. Bu duruma göre yüksek sıcaklık, düşük basınç koşullarında molekül kütlesi küçük olan gazlar idealliğe yaklaşırlar. (Molekül kütlesi büyük olan gazlar küçük olanlara oranla daha fazla moleküller arası etkileşime sahiptir.)
Gerçek gaz ise; tanecikleri arasında itme ve çekme kuvvetleri olan ve toplam hacim yanında taneciklerin hacmi ihmal edilmeyen gazlardır.
Graham Difüzyon Kanunu
Gaz taneciklerinin birbiri içinde dağılmasına difüzyon denir.
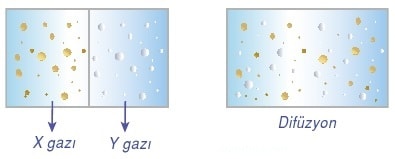
Bir gazın çok küçük bir delikten sızarak diğer tarafa yayılmasına efüzyon denir. Futbol topunun patladığında havasının inmesi gazların efüzyon olayıyla ilgilidir.
Kapalı bir kaptaki gaz molekülünün ortalama kinetik enerjisi Ek =1/2.m.v2 formülünden bulunur. (Ek = Kinetik enerji, m = Taneciğin kütlesi, v = Gaz molekülünün hızı).
X ve Y gazları aynı ortamda olduklarından sıcaklıkları aynıdır. Dolayısıyla kinetik enerjileri eşittir. Bu eşitlikten yararlanarak denklem kurduğumuzda gazlar için difüzyon hızının mol ağırlığının karekökü ile ters orantılı olduğunu çıkarırız.
Vx / Vy = √MAy / √MAx formülü elde edilir. Bu formül gazlar için çok önemlidir.
Yukarıdaki bağıntı Graham difüzyon yasası olarak bilinir.
Hız birim zamanda alınan yol olduğundan hız yerine yol alınabilir.
Gazlar aynı kapta olduklarından hacimleri eşittir. Aynı koşullarda yoğunluk ile molekül ağırlığı doğru orantılı olduğundan, mol kütlesi yerine yoğunluk da formülde kullanılabilir.
Sonuç olarak mutlak sıcaklık ile kinetik enerji doğru orantılıdır. Kinetik enerji ise hızın karesiyle doğru orantılıdır.
Gazları Niteleyen Büyüklükler
Mol sayısı, hacim, sıcaklık ve basınç bir gazı tam olarak niteleyen büyüklüklerdir.
Mol sayısı: Gazın miktarı mol sayısı ile verilir. Kütlesi verilen bir gaz örneğinin mol sayısı hesaplanabilir. Bütün kimyada geçerli olan n = m/MA formülü ile gazlarda mol sayısı elde edilebilir.
Bağıntıda n maddelerin mol sayısını, m kütlesini ve MA ise mol kütlesini belirtir. Mol sayısının birimi mol, kütlesinin birimi gram ve mol kütlesinin birimi de g/mol'dür.
Gaz hacmi: Gaz tanecikleri sürekli hareket halinde olduğundan içine konuldukları kabı doldurmak üzere genişlerler. Dolayısıyla bulundukları kabın hacmini ve şeklini alırlar.
Gaz hacmi m3, dm3(L), cm3(mL) birimleri ile ifade edilir.
1m3 = 10dm3 = 103L = 106cm3 = 106ml
Sıcaklık: Bir gazın sıcaklığı gaz taneciklerinin ortalama kinetik enerjisi ile doğru orantılıdır. Sıcaklık arttıkça taneciklerin hızı artar. Taneciklerin hızının artması kabın çeperlerine ve birbirlerine yaptıkları çarpma sayısını artırır.
Sıcaklık termometre ile ölçülür. Sıcaklık kütleden bağımsızdır.
Sıcaklık birimi olarak kimyada en çok kullanılanlar celcius (°C) ve kelvin (°K) birimleridir. Gazlarla ilgili tüm eşitliklerde kelvin (°K) birimi kullanılır. Bu birimler arasında aşağıdaki eşitlik vardır.
T(°K) = T(°C) + 273
0°C'ta mutlak sıcaklık 273°K’dir.
Gaz basıncı: Bir gazın molekülleri sabit bir hızda hareket ederken birbirleriyle ve kabın çeperleriyle çarpışırlar. Gaz moleküllerinin kabın çeperlerine çarpması sonucu oluşan kuvvete gaz basıncı denir.
Basınç birimi arasında; 1 atm = 76 cmHg =760 mmHg =760 torr = 101.325 Pa ilişkisi vardır.
Hava bir gaz karışımıdır ve yeryüzüne ağırlığından dolayı bir basınç uygular. Bu basınca açık hava basıncı ya da atmosfer basıncı denir. Atmosfer basıncı barometre ile ölçülür.
Torricelli deneyi olarak bilinen deneyle atmosfer basıncı ölçülmüştür. Bu deneyde uzun bir deney tüpü cıva ile doldurulup daha sonra cıva dolu bir kap içerisine ters çevrilir. Belli bir süre sonra deney tüpündeki cıvanın bir kısmı kabın içerisine basılır ve deney tüpü belli bir seviyeye kadar cıva ile dolu olur. Açık hava basıncı tüp içerisindeki civanın basıncını dengelemektedir.
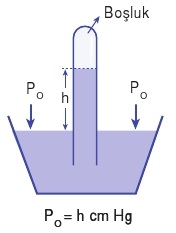
Sıvı olarak civanın kullanılmasının sebebi civanın yoğunluğu büyük olduğu için çok uzun tüp gerektirmemesidir. Kullanılan sıvının yoğunluğu düştükçe tüpteki yükseklik artar.
Cıva yerine başka bir sıvı kullanılırsa yüksekliği hsıvı.dsıvı = hHg.dHg formülü ile hesaplanır. (dHg = 13,6 g/cm3)
Manometreler
Kapalı kaplardaki gaz basıncını ölçen aletlere manometre denir. Manometreler farklı şekilde ayarlanmış olabilir. Örneğin ucu kapalı manometrede cıva yüksekliği doğrudan gaz basıncını verirken, açık uçlu manometrede gazın basıncının açık hava basıncına göre durumu verilir.
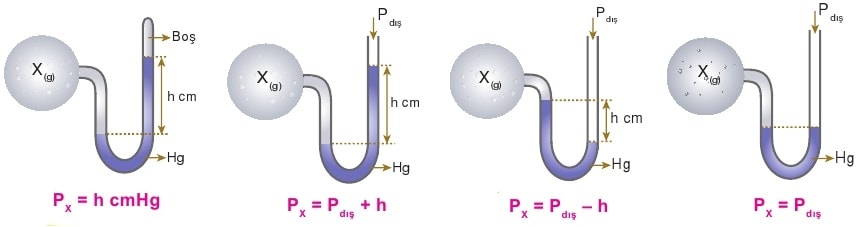
Yukarıdaki resimde manometreler ile ölçüm yapılabilen çeşitli durumlar gösterilmiştir. Manometre problemlerini çözebilmek için bu durumları kavramak önemlidir.
İdeal Gaz Kanunları
Gazların basınç, hacim, sıcaklık ve mol sayısı değişkenlerinden ikisi sabitken diğerlerinin birbirine nasıl bağlı olduğu gaz yasaları ile belirtilmiştir.
Boyle - Mariotte Kanunu
Sabit sıcaklıkta belli miktar gazın basıncı ile hacmi ters orantılıdır. Bu kanunla n ve T sabit iken P - V ilişkisi ortaya konmuştur.
Buna göre sıcaklık ve mol sayısı eşitken iki gaz için hacim ve basınç çarpımı birbirine eşittir. Yani P1.V1 = P2.V2 olur.
Charles Kanunu
n ve P sabit iken V - T ilişkisi ortaya konmuştur. Sabit basınç altında ideal pistonlu bir kapta bulunan bir miktar gazın mutlak sıcaklığı ile hacmi doğru orantılıdır.
Bunu iki gaz için bir eşitliğe dökersek mol sayısı ve basınç aynı iken V1/T1 = V2/T2 olur.
Gay - Lussac Kanunu
V ve n sabit iken T - P ilişkisi ortaya konmuştur. Sabit hacimli bir kapta bulunan bir miktar ideal gazın basıncı ile mutlak sıcaklığı doğru orantılıdır.
Yani P1/T1 = P2/T2 olur. Burada basınç ve sıcaklığın doğru orantılı olduğu da kolaylıkla görülür.
Avogadro Hipotezi
P ve T sabit iken n - V ilişkisi ortaya konmuştur. Aynı koşullarda (sabit sıcaklık ve basınçta) bulunan gazların hacimleri mol sayısı ile doğru orantılıdır.
Bu hipoteze göre sabit basınç ve sıcaklık varken iki gaz için V1/n1 = V2/n2 eşitliği elde edilir.
İdeal Gaz Denklemi
Gaz yasaları kullanılarak ideal gaz denklemi türetilir. Yukarıda verdiğimiz bütün hipotez ve kanunları birleştirsek elimize çok daha basit bir eşitlik gelecektir. Yukarıdaki verileri oranlığımız zaman;
P.V = n.R.T denklemi ortaya çıkar.
Bu denkleme ideal gaz denklemi denir. Buradaki R (Raydberg sabiti) bir sabittir ve 22,4 / 273 = 0,082 değerindedir.
Basınç (P) birimi atm olmalıdır.
Gazların hacmi (V) litre biriminden yazılmalıdır. Gazın sıcaklığı (T) kelvin cinsinden yazılmalıdır.
Birleşik Gaz Denklemi (Genel Gaz Denklemi)
Bir gazın iki durumunu veya iki gazı karşılaştırmak için birleşik gaz denklemi kullanılır.
İki ideal gaz denklemi birbirine orantılandığında birleşik gaz bağıntısı elde edilir.
Hacim değişmeksizin ya da kapalı çelik bir kapta gibi ifadeler kullanılan sorularda formülden hacim sadeleştirilir.
Sabit sıcaklıkta ya da aynı sıcaklığa dönüldüğü gibi ifadelerinin kullanıldığı sorularda formülden sıcaklık sadeleştirilir.
Sabit basınçta ya da ideal pistonlu kapta ifadelerinin kullanıldığı sorularda formülden basınç sadeleştirilir.
Kısacası soruda sabit kabul edilen verilen formülden sadeleştirilir.
Yukarıda ideal gaz denkleminde R diye bir sabitten bahsetmiştik. Bu sabit bütün ideal gazlar için aynı olduğundan denklemin bir tarafında yalnız bıraktığımızda genel gaz denklemini elde ederiz.
P1.V1/n1.T1 = P2.V2/n2.T2 = R formülünden bütün ideal gaz soruları çözülür. Sabit ya da eşit verilen değerleri denklemde sadeleştirebilir.
Gazların Karıştırılması
Birbirleriyle tepkime vermeyen gazlar birleşik kap sisteminde sabit sıcaklıkta karıştırıldıklarında gazların P.V değeri gazların mol sayılarına eşittir.
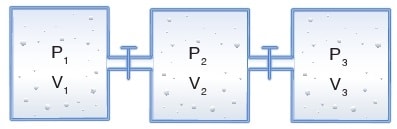
Buna göre, musluk açılırsa P1, V1 birinci kaptaki gazın mol sayısını, P2, V2 ikinci kaptaki gazın mol sayısını, P3, V3 üçüncü kaptaki gazın mol sayısını, Pson, Vtopise son durumdaki toplam mol sayısını gösterir.
İdeal gaz denklemi ilk durumlar için ve son durum için eşitlenecek şekilde yazılır. Zira ideal gaz için her durumda geçerlidir.
Birleşik kap sisteminde musluklar açılıp yeterince beklendiğinde her bir gazın yeni hacmi sistemin hacmine eşit olur. Basınç ise kabın her noktasında eşittir.
Gazların Yoğunluğu
Gazların yoğunluğu ile ilgili uygulamalar için, ideal gaz denklemini yoğunluk niceliği ile beraber tekrar düzenleyebiliriz.
Yoğunluğun kütlenin hacme bölümü olduğunu biliyoruz. Yani d = m/V maddenin bütün fazları için geçerlidir. Biz burada ideal gaz denklemi içine bu eşitliği yazarak yeni bir eşitlik elde edeceğiz.
İdeal gazlar için geçerli olan formülde n mol sayısını veriyordu. Mol sayısı da her zaman n = m/MA ile bulunur. İdeal gaz denkleminde V yerine m/d, n yerine de m/MA yazarsak yeni bir bağıntı elde ederiz.
P.MA = d.R.T bağıntısı bu şekilde ortaya çıkar. Bazı sorularda mol kütlesi veya yoğunluk verildiğinde doğrudan bu formülü kullanabiliriz.
Gazlarda hacim (V)'in birimi genellikle litre olduğundan yoğunluğu birim g/L'dir.
Gazın yoğunluğu basınç, mutlak sıcaklık ve molekül ağırlığı ile değişebilir.
Sabit hacimli kapta sıcaklık artırılırsa kabın hacmi ve kütlesi değişmediğinden yoğunluk değişmez.
Dalton'un Kısmi Basınçlar Kanunu
İdeal gaz kanunu tek tek gazlara uygulandığı gibi birbirleriyle etkileşmeyen gaz karışımlarına da uygulanabilir. Gazların kısmi basıncı John Dalton tarafından incelenmiştir.
Sabit hacimli kapalı bir kapta sabit sıcaklıkta bulunan gaz karışımının kaba yaptığı basınca toplam basınç, gazlardan birinin kaba yaptığı basınca o gazın kısmi basıncı denir.
Kısmi basınç problemlerinde aynı ortam geçerli oldu için hacim ve sıcaklık aynı olacaktır. Dolayısıyla gazların mol sayıları basınçları ile doğru orantılı olur.
Örneğin bir kapta 3 mol X gazı ve 2 mol Y gazı olsun. Bu durumda toplam basıncın 10 Atm olduğunu düşünürsek X gazının kısmi basıncı 6 Atm, Y gazının kısmi basıncı ise 4 Atm olur. Toplam basınç kısmi basınçların toplamıdır.
Gazların Su Üzerinde Toplanması
Su üzerinde gaz toplama yöntemi karışımlardaki gazları saf olarak elde etmek için kullanılır.
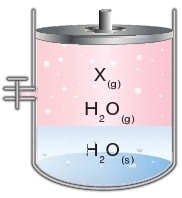
Suda çözünmeyen ve su ile tepkimeye girmeyen gazlar su üzerinde toplanır. Şekildeki kapta buharı ile dengede olan bir miktar saf su ve üzerinde suda çözünmeyen X gazı bulunmaktadır.
Kaptaki toplam basınç, X gazının basıncı ile suyun buhar basıncı toplamına eşittir.
Suyun buhar basıncı suyun sıcaklığına ve saflığına bağlı olarak değişir. Ancak suyun miktarına, bulunduğu kabın hacmine, şekline ve üzerine uygulanan basınca bağlı değildir.
X gazının basıncı ise, kabın hacmine, X gazının mol sayısına ve sıcaklığına bağlı olarak değişir.
Gerçek Gazlar
Kinetik teoriyi ifade ederken ideal gaz ve gerçek gaz kavramlarından bahsetmiştik.
Gaz tanecikleri arasında çekim kuvvetinin olmadığı ve gaz taneciklerinin hacimlerinin sıfır kabul edildiği gazlara ideal gaz demiştik ve gerçekte böyle olmadığını belirtmiştik.
Dolayısıyla günlük hayatta karşılaştığımız gazların tamamı gerçek gazdır. Fakat gerçek gazların bazıları İdeal gaz durumuna yakın, bazıları da ideal gaz durumundan uzak özellik gösterirler.
Gerçek gazlarda tanecikler arası İtme - çekme kuvvetleri ve tanecik hacimleri ihmal edilmez. Bu nedenle gerçek gazlarla yapılan deneylerde elde edilen sonuçlar ideal gaz denklemine göre yapılan hesaplamalardan elde edilen sonuçlara göre farklılık gösterir.
İdeal gazlar için verdiğimiz formül gerçek gazlarda tam olarak çalışmaz.
Gazların İdeal Halden Sapması
Gaz basıncı İle ilgili olarak yapılan deneylerde, gerçek gazların basıncının, ideal gaz denklemine göre hesaplanan basınç değerinden küçük olduğu gözlemlenmiştir.
Gerçek gazların basıncındaki bu düşmenin nedeni gaz tanecikleri arasındaki çekim kuvvetinden kaynaklanır. Tanecikler arası çekim kuvveti arttıkça gerçek gazın basıncı küçülür.
Gerçek gazların sıcaklıkları artırıldığında gaz tanecikleri arasındaki çekim kuvveti azalır ve gaz idealliğe yaklaşır.
Gerçek gazın hacmi artırıldığında gaz tanecikleri arası mesafe arttığı için aralarındaki etkileşim azalır ve yine gaz idealliğe yaklaşır.
Gaz hacmi ile ilgili yapılan deneylerde gerçek gazların hacminin, ideal gaz denklemine göre hesaplanan hacim değerinden büyük olduğu gözlenmiştir.
Gerçek gazların hacmindeki bu artışın nedeni, gaz taneciklerinin öz hacminin dikkate alınmasıdır. Yani öz hacmi küçük olan gazlar, büyük olan gazlara göre daha idealdir.
İdeal bir gaz hacminin elde edilebilmesi için moleküllerin öz hacimlerinin gerçek bir gazın kapladığı hacimden çıkarılması gerekir.
Joule Thomson Olayı
Soğutma sistemine sahip elektrikli ev aletlerinin bulunmasından önce insanlar yiyeceklerini uzun süre saklayabilmek için dağlardan getirdikleri buz ve karları kullanırlardı. Bu tür imkanlara sahip olunamayan yerlerde ise yiyeceklerin bozulmasını engellemek için tuzlama, kurutma, kavurma ve konserve etme gibi işlemler yapılmaktaydı.
Bir maddeyi soğutmanın temel prensibi, kendisinden daha soğuk bir madde ile temas etmesini sağlamaktır.
Sıvılaştırılmış gazlar bulundukları ortamı soğutma özelliğine sahiptir. Örneğin sıvılaştırılmış hava bulunduğu ortamı -180°C'a kadar, sıvılaştırılmış hidrojen gazı ise -250°C'a kadar soğutabilmektedir.
James Prescott, Joule ve William Thomson adlı bilim insanları, gazların sıvılaşması ve genleşmesi ile ilgili olarak birbirine benzeyen düzeneklerle çalışmalar yapmışlardır. Bu çalışmalar, sıkıştırılmış gazların aniden genleştirilmesi esasına dayanmaktadır. Kapalı bir kapta sıkıştırılmış bir gaz küçük bir delik yardımıyla boş olan başka bir kaba aktarıldığında aniden genleşir ve bu sırada hızlarında ani düşüşler olur. Bu da gazın kinetik enerjisinin ve dolayısıyla sıcaklığının düşmesine neden olur.
Gazın genleşmesi sırasında molekülleri arasındaki çekim kuvvetlerinin kırılması için enerji gerekir. Madde bu iş için kendi enerjisini kullanır. Ani genleşme sonucunda gazların sıcaklığındaki bu düşme olayı "Joule - Thomson Olayı" olarak adlandırılır.
Joule - Thomson olayı günlük yaşantımızda sıklıkla karşımıza çıkar. Örneğin buzdolabı, klima, derin dondurucular vb.
Bir gazın sıcaklığı ne kadar yüksek ise sıvılaşması o kadar yüksektir. Her gaz için ayrı olan bu yoğunlaşma sıcaklığına kritik sıcaklık adı verilir. Yani kritik sıcaklık, bir gazın basınç uygulanarak sıvılaştırabileceği en yüksek sıcaklıktır.
Bir gazı kritik sıcaklığında sıvılaştırmak için gerekli olan minimum basınca kritik basınç denir.
Kritik sıcaklık değeri ve altındaki sıcaklıklarda gaz gibi davranan ancak, belirli bir basınç değerinden sonra sıkıştırıldığında sıvılaşabilen akışkana buhar denir.
Kritik sıcaklık değerinin üzerindeki sıcaklıkta herhangi bir basınç altında sıvılaşamayan akışkanlara ise gaz adı verilir.
Soğutucu Akışkanlar
Belli bir basınç altında buharlaşırken ortamdan ısı alarak ortamın soğumasını sağlayan akışkanlara soğutucu akışkanlar denir.
Oda koşullarında gaz halinde bulunan maddeler, soğutucu akışkan olarak kullanılamaz. Soğutucu akışkan olarak kullanılabilmesi için kaynama noktasının oda sıcaklığından çok düşük, kritik sıcaklığının ise çok yüksek olması gerekir. He, Ne, 02, . . . gibi gazlar ve oda koşullarında sıvı olan su soğutucu akışkan olarak kullanılamaz.
Freon-12 (CCI2F2) ve amonyak gibi gazlar soğutucu akışkan olarak kullanılırken Freon-12 gazının ozon tabakasına etkisi ve amonyağın zehirli, patlayıcı bir gaz olmasından dolayı günümüzde kullanımını yitirmiştir.
Soğutucu akışkanlar şu özelliklere sahip olmalıdır:
- Buharlaşması ve sıvılaşması uygulanabilir basınçlar altında olmalıdır.
- Buharlaşma sıcaklığı mümkün olduğunca düşük olmalıdır.
- Kimyasal olarak ayrışmamalı, yanmamalı, zehirli olmamalı ve metal yüzeylerle reaksiyona girmemelidir.
- Düşük güç ile çalışabilmelidir.
- Maliyeti düşük olmalı ve kolay temin edilebilmelidir.
- Canlı hayatına zararlı etkileri olmamalı, çevreyi kirletmemelidir.
- İçinden geçtiği boru vs. paslandırmamalıdır.
En çok kullanılan soğutma akışkanları şunlardır: Freon 22, Freon 134a, Freon 407c, Freon 410A (Ozona zararsızdır. ) 407c'nin muadili olup daha verimli olduğundan 407c nin yerini tamamen almıştır.
