Maddenin Sıvı ve Katı Hali
Bu konu başlığı altında maddenin sıvı hali ve maddenin katı hali incelenecektir. Maddenin sıvı ve katı hal durumunda gösterdikleri özellikler maddeleri tanımamız açısından önemlidir.
Maddenin Sıvı Hali
Maddenin üç temel halinden biri de sıvı halidir. Sıvı haldeki tanecikler birbirleri üzerinden kayarak hareket ederler. Sıcaklık arttıkça sıvı moleküllerinin hareketi artar. Sıvı molekülleri titreşim ve öteleme hareketi yaparlar. Bu hareketler sonucunda bulundukları kabın hacmini alırlar. Sıvı molekülleri arasındaki boşluk, gaz molekülleri arasındaki boşluktan az olduğu için birbirleri arasında daha çok çarpışma yaparlar. Bilinen en önemli sıvı sudur.
Yüzey Gerilimi
Sıvıların önemli özelliklerinden biri de moleküller arası çekim kuvvetinden kaynaklanan yüzey gerilimidir. Sıvı moleküllerinin yüzey alanını artırmak için gereken enerjiye ya da yapılan işe yüzey gerilimi denir.
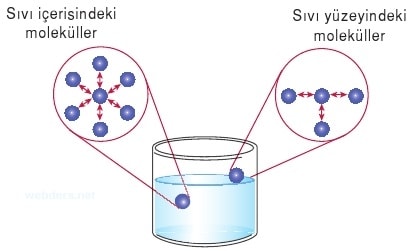
Sıvılarda içteki moleküller diğer moleküller tarafından her yönden eşit kuvvetle çekilir. Sıvı yüzeyindeki moleküller içteki moleküller tarafından aşağıya doğru çekileceğinden sıvı yüzeyi küre şeklini alır.
Yüzey gerilimine etki eden çeşitli faktörler bulunur. Bu faktörleri sıvının cinsi, sıcaklık, sıvının saflığı şeklinde sıralayabiliriz.
Sıvının Cinsi
Tanecikler arasındaki çekim kuvvetleri büyük olan (kohezyon kuvvetleri) sıvıların yüzey gerilimleri daha büyüktür. Su molekülleri arası hidrojen bağlarından dolayı diğer birçok sıvılara göre daha yüksek yüzey gerilimine sahiptir.
Sıcaklık
Sıcaklığın artmasıyla tanecikler arası etkileşim azalır ve yüzey gerilimi düşer. Sıcaklıkla yüzey gerilimi ters orantılıdır. Sıcaklığın düşmesiyle tanecikler arası etkileşim artacağından yüzey gerilimi de artar.
Sıvının Saflığı
Bir sıvı içerisine eklenen safsızlık, taneciklerin birbirleri içerisinde çözünmesiyle meydana gelir. Sıvının kendi molekülleri arasındaki çekim kuvvetleri değişeceği için yüzey gerilimi değişir. Çözücünün yüzey gerilimini düşüren maddelere yüzey aktif, değiştirmeyen maddelere ise yüzey inaktif madde denir.
Yüzey aktif maddeler deterjan, organik asitler, alkoller, esterler, ketonlar, aminler… Yüzey inaktif maddeler ise organik asit tuzları, bazlar, şeker ve gliserin gibi maddeler örnek verilebilir.
Adhezyon ve Kohezyon Kuvvetleri
Sıvı moleküllerinin bir yüzeyi ıslatması ya da ıslatmaması iki kuvvetin etkisine bağlıdır. Bunlar adhezyon ve kohezyon kuvvetleridir.
Sıvı molekülleri ile temas ettiği yüzey arasındaki çekim kuvvetleri adhezyon kuvvetleri olarak adlandırılır.
Sıvının kendi tanecikleri arasındaki çekim kuvvetleri ise kohezyon kuvvetleri olarak adlandırılır.
Eğer adhezyon kuvvetleri, kohezyon kuvvetlerinden büyükse, sıvı yüzeye yayılır ve ıslatır.
Kohezyon kuvvetleri, adhezyon kuvvetlerinden büyük olduğu durumlarda ise sıvı damlası biçimini korur ve yüzeyi ıslatmaz.
Adhezyon kuvvetleri, kohezyon kuvvetlerinden büyük olduğu durumlarda sıvı kapiler boru içerisinde kendiliğinden yükselir (Kapiler etki).
Kağıt peçetenin, havlunun ya da süngerin suyu emmesi kapiler etki ile ilgilidir.
Viskozite
Sıvıların akmaya karşı gösterdiği direnç viskozite olarak adlandırılır.
Viskozitesi büyük olan sıvılar küçük olanlara göre daha yavaş akar. Örneğin balın akıcılığı, suyun akıcılığından daha küçüktür. Çünkü balın viskozitesi suyunkinden büyüktür.
Sıcaklık arttıkça sıvıların viskozitesi azalır, akıcılığı artar. Örneğin viskozitesi yüksek olan asfalt yola dökülmeden ısıtılır viskozitesi azaltılarak akışkan hale getirilir.
Sıvıların molekülleri arasındaki çekim kuvvetinin büyüklüğü ile viskozite doğru orantılıdır.
Hal Değişimleri
Maddenin üç temel hali vardır. Bunlar katı, sıvı ve gaz halleridir. Maddenin hali sıcaklık ve basınç etkilerine göre değişir.
Maddenin Plazma Hali
Maddenin dördüncü hali olan plazma, gaz halindeki maddelere enerji verildiğinde bazı gaz atomlarında elektron veya elektronlar koparılabilir.
Bir süre sonra ortamda nötr atomlarla birlikte serbest elektron ve iyonlardan oluşan bir karışım bulunur. Bu karışıma plazma (iyonize olmuş gaz) denir.
Bu hale örnek güneş, şimşek, yıldırımlar, floresan lambalar, plazma televizyonlar verilebilir.
Hal Değişim Olayları
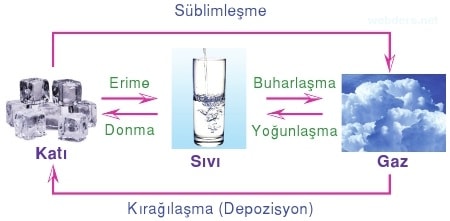
Maddenin bir halinden başka bir haline dönüşmesine hal değişimi denir.
Katı maddenin ısı alarak sıvı hale geçmesi olayına erime, sıvı maddenin ısı alarak gaz hale geçmesine buharlaşma, gaz halindeki maddenin ısı vererek sıvı hale geçmesine yoğunlaşma, sıvı maddenin ısı vererek katı hale geçmesine donma denir.
Maddenin katı halden sıvı hale uğramadan gaz hale dönüşmesine süblimleşme, gaz haldeki maddenin sıvı hale uğramadan katı hale dönüşmesine kırağılaşma denir.
Saf Maddelerin Hal Değişimi
Saf maddeler ısıtıldığında veya soğutulduğunda sıcaklıkları değişerek belirli bir noktada hal değiştirebilirler. Alınan veya verilen enerji maddenin yapısında değişikliklere neden olabilir. Katı olan bir madde aldığı enerjiyle ısısını ve sıcaklığını artırarak belli bir basınç altında erime noktasına geldiğinde erime süreci başlar. Enerji verilmeye devam edilirse, erimesi tamamlanan madde sıcaklığını kaynama noktasına kadar artırır.
Kaynama sıcaklığında alınan enerji sıcaklığı değiştirmeden maddenin tamamını gaz haline getirip kaynama olayını tamamladıktan sonra sıcaklık artışı devam eder.
Herhangi bir saf maddenin belli bir basınç altında ısıtılmasına ait hal değişim grafiği aşağıdaki gibidir.
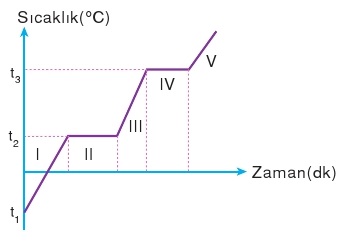
I, III ve V bölgelerinde hal değişimi yoktur. Verilen ısı sıcaklık artışına neden olur. Bu bölgelerdeki hesaplamaları Q = m.c.Δt formülü kullanılır.
II ve IV bölgelerinde ise hal değişimi vardır ancak sıcaklık artışı yoktur. Bu bölgelerde ise Q = m.L formülü kullanılır.
Q = Maddenin aldığı veya verdiği ısıdır. Birimi kalori veya Joule alınabilir.
m = Hal değiştiren maddenin kütlesidir. Birimi gramdır.
c = Öz ısı diğer adıyla ısınma ısısıdır. Maddenin 1 gramının sıcaklığını 1°C artırmak için gereken ısı miktarıdır. Birimi Joule/gram.°C olarak alınır. (1000 J = 1 kJ)
Δt = Son sıcaklık ile ilk sıcaklık farkıdır. Birimi °C alınır.
L = Hal değişim ısısıdır. Maddenin 1 gramının hal değiştirmesi için gereken ısıdır. Eriyen maddeler için erime ısısı (Le), buharlaşan maddeler için buharlaşma ısısı (Lb) olarak ifade edilir.
Erime sıcaklığındaki bir mol katının erimesi için gereken ısıya molar erime ısısı, kaynama sıcaklığındaki bir mol sıvının tamamen buharlaşması için gereken ısıya molar buharlaşma ısısı denir.
Isıl Denge
Farklı sıcaklıklarda bulunan maddeler birbirleri ile karıştırılır ya da temas ettirilirse aralarında bir ısı alış verişi olur. Bu maddeler arasında bir tepkime olmuyorsa ortak bir sıcaklık değerine ulaşılana kadar aralarındaki ısı alışverişi devam eder. Bu duruma ısıl denge denir.
Isıl denge kuruluna kadar soğuk olan maddenin aldığı ısı, sıcak olan maddenin verdiği ısıya eşittir.
Alınan ısı = Verilen ısı
Sıvı Buhar Dengesi ve Kaynama
Sıvı kapalı bir kaba konduğunda zamanla sıvının buharlaşmasından dolayı gaz fazındaki tanecik sayısı artar. Gaz fazındaki bu tanecikler hareketleri sırasında sıvı yüzeyine çarparak sıvı faza geçebilirler. Öyle bir an gelir ki, birim zamanda gaz fazına geçen molekül sayısı ile sıvı faza geçen molekül sayısı birbirine eşit olur. Bu duruma sıvı - buhar dengesi denir. Bu andaki buharların basıncına da buhar basıncı denir.
Sıvının buhar basıncının içinde bulunduğu kabın hacmi, şekli ve sıvı miktarı etkilemez.
Sıvı - buhar denge basıncı
Sıvının cinsine bağlıdır. Tanecikler arası çekim kuvveti küçük olan sıvıların uçuculukları fazladır. Bu nedenle denge buhar basınçları da büyük olur.
Sıvının saflığına bağlıdır. Uçucu olmayan katı maddeler bir sıvı içinde çözünecek olursa tanecikler arasındaki çekim kuvvetleri artacağından uçuculuk azalır. Dolayısıyla denge buhar basıncı azalır.
Sıvının sıcaklığına bağlıdır. Sıcaklık arttıkça tanecikler arası çekim kuvveti azalır, denge buhar basınçları artar.
Kaynama
Sıvı ısıtıldığında sıcaklığı ve yüzeyindeki buhar basıncı giderek artar. Bir süre sonra sıvının buhar basıncıyla atmosfer basıncı birbirine eşit olur.
Bu durumda yeterli kinetik enerjiye sahip sıvı moleküller gaz fazına geçerler. Bu olaya kaynama denir. Bu sıradaki sıcaklığa da kaynama noktası denir.
Sıvılar her sıcaklıkta buharlaşır ancak kaynama noktasına ulaştığında kaynar. Her sıvının kaynama noktası tek bir sıcaklıktır. Dolayısıyla buharlaşma ile kaynama karıştırılmamalıdır.
Kaynama noktası açık hava basıncına bağlıdır. Açık hava basıncı artarsa kaynama noktası da artar.
Buharlaşma hızı sıcaklık ve yüzey alanına bağlıdır. Sıcaklık arttıkça ve yüzey alanı büyüdükçe buharlaşma hızı artar.
Bağıl Nem
Dünyadaki su döngüsü, suyun buharlaşması ve yoğunlaşması temeline dayanır. Havanın içeriğinde aslında sürekli olarak su buharı da bulunmaktadır. Bu şekilde ifade edilen hava nemli hava olarak tanımlanır. İçerisinde su buharı içermeyen hava kuru hava olarak tanımlanır.
Havadaki su buharının kısmi basıncının, aynı sıcaklıktaki suyun denge buhar basıncına oranı bağıl nem olarak tanımlanır ve yüzde ile verilir.
Bağıl nem = Su buharının kısmi basıncı/Suyun denge buhar basıncı.100
Bağıl nem % 100 den büyük olduğunda sıcaklık düşükse nem yağış olarak yeryüzüne iner.
Maddenin Katı Hali
Katıların türü, atom, molekül ya da iyonları bir arada tutan kuvvetlere bağlıdır. Katı maddeler amorf katılar ve kristal katılar olmak üzere ikiye ayrılır.
Amorf Katılar
Atom, iyon yada moleküllerin rastgele yığıldığı, sert, sıkıştırılamayan ve belirli geometrik kristalleri olmayan katılara amorf katılar denir. Plastikler, cam, tereyağı, lastik gibi katılar amorf katılara örnek olarak gösterilebilir.

Amorf katılar ısıtıldıklarında belirli bir sıcaklık aralığında yumuşarlar, yumuşamanın başladığı sıcaklığa camsı geçiş sıcaklığı denir.
Kristal Katılar
Atom iyon ya da moleküllerin düzenli bir şekilde sıralandığı, sert, sıkıştırılamayan ve belirli geometrik şekle sahip kristalleri bulunan katılara kristal katılar denir. Tuz, şeker, elmas, altın, gümüş gibi katılar kristal katılara örnek olarak gösterilebilir.
Kristal katılar kristal örgüde yer alan kürlere göre şöyle sınıflandırılır:
- İyonik kristaller
- Kovalent kristaller
- Moleküler kristaller
- Metalik kristaller
İyonik Kristaller
Yüklü parçacıklardan oluşurlar. Örgü noktalarında + ve - yüklü iyonlar bulunur. Dolayısıyla katıyı bir arada tutan kuvvetler bu iyonlar arasındaki elektrostatik çekme kuvvetidir. İyonik kristallere örnek olarak KCI, CaSO4, ZnS vb. verilebilir.

İyonik kristallerin erime noktaları yüksektir. Katı halde elektriği iletmezler. Ancak suda çözündüklerinde ve eritildiklerinde elektriği iletirler. Kırılgandırlar.
Kovalent Kristaller
Örgü noktalarında atomlar bulunur. Kovalent kristaller, katının bütünü içindeki atomlar arasında oluşan kovalent bağ örgüsü ile meydana gelirler. Bu kovalent bağlar, kristal içinde üç boyutlu bir ağ yapısı oluştururlar. Kovalent kristallere örnek olarak elmas, SİC, SİO2 ... vb. verilebilir.
Kovalent katılar çok sert olup, yüksek erime noktasına sahiptirler. Elektrik akımını iletmezler.
Moleküler Kristaller
Örgü noktasında moleküller ya da atomlar bulunur. Örgü noktalarındaki türler arasında da dipol - dipol, dipol - indüklenmiş dipol, London kuvvetleri, hidrojen bağları gibi bağlar meydana gelir. Moleküler kristallere örnek olarak CO2 (kuru buz), H2O (buz), C12H22O11 (şeker) ... vb. verilebilir.
Bu kristaller yumuşaktırlar ve genellikle erime noktaları düşüktür. Elektrik akımı iletmezler.
Metalik Kristaller
Her örgü noktasında aynı metalin katyonları bulunur, bu katyonlar belirli bir düzene göre yerleşmiş olup tüm katı boyunca elektron bulutlarıyla çevrilmişlerdir. Örgüdeki bağlar ise + yüklü iyonlar ile serbest elektronlar arasındaki elektrostatik çekme kuvvetlerinden ileri gelir. Metalik katılara örnek olarak Na, Mg, Ag, Au . . . vb. verilebilir.
Metalik kristaller, sertten yumuşağa doğru değişen sertliğe düşükten yükseğe doğru değişen erime sıcaklığına sahiptirler.
Parlaklıkları, tel ve levha haline gelebilmeleri, ısı ve elektrik iletkenlikleri elektron bulutlarının hareketliliğinden kaynaklanır.
