Değerlik Elektron Sayısı Nedir?
Kimya dersinde deÄŸerlik elektron kavramıyla çok karşılaşırız. Konuyu anlamadığımız zaman da sürekli problem yaÅŸarız. Bu yazıda deÄŸerlik elektron sayısı nedir ve nasıl bulunur bunun üzerinde durmaya çalışacağız.
Özellikle lise kimyasında 9.sınıftan baÅŸlayarak deÄŸerlik elektron sayısı ile mücadele etmeye baÅŸlarız. Konuya girmeden önce atom, element ve elektron kavramlarını bildiÄŸimizi varsayıyoruz. Bu kavramları bilmiyorsanız kısaca öÄŸrenmek için ilgili linkler aÅŸağıda bulunmaktadır.
DeÄŸerlik elektronlarına valans elektronlar da denir. Bu elektronların sayısı elementin nasıl bir kimyasal özellik gösterdiÄŸi konusunda bize bilgi verir. Çünkü kimyasal baÄŸlar bu elektronlar aracılığıyla kurulur.
Değerlik Elektron Sayısı Nasıl Bulunur?
Bir atomun Lewis nokta yapısını ya da elektron konfigürasyonunu bilirsek deÄŸerlik elektron sayısını da kolaylıkla bulabiliriz. Tanımda söylediÄŸimiz gibi son yörüngedeki elektron sayısına bakmamız yeterlidir.
ÖrneÄŸin birkaç atomun deÄŸerlik elektron sayılarını bulmak için elektron konfigürasyonlarını yazalım.
- H: 1s1 en büyük yörünge olan birinci yörüngede 1 elektron vardır.
- He: 1s2 en büyük yörüngede 2 elektron vardır.
- Li: 1s2 2s1 en büyük yörünge olan ikinci yörüngede 1 elektron vardır.
- Be: 1s2 2s2 en büyük yörüngede (2s orbitali) 2 elektron vardır.
- B: 1s2 2s2 2p1 deÄŸerlik elektron sayısı 3’tür. (2 tane s orbitalinde 1 tane p orbitalinde)
- Ne: 1s2 2s2 2p6 deÄŸerlik elektron sayısı 8’dir. (2 s orbitalinde, 2 p orbitalinde) (orbitaller dolu olduÄŸu için baÄŸ yapmaz. Neon soygazdır.)
GörüldüÄŸü gibi son orbitallerde deÄŸerlik elektron sayısı bulmak epey kolaydır. Aslında daha kolayını da söylersek bir atomun deÄŸerlik elektronlarının sayısı bize genellikle periyodik tabloda hangi grupta olduÄŸunu da söyler.
Bu durum kimya dersinde çok kullandığımız A grubu elementleri için birebir uymaktadır. AÅŸağıdaki tabloda periyodik tablodaki A gruplarının deÄŸerlik elektron sayıları verilmiÅŸtir.
| Grup numarası | Değerlik elektron sayısı |
|---|---|
| 1A (alkali metaller) | 1 |
| 2A (toprak alkali metaller) | 2 |
| 3A (bor grubu) | 3 |
| 4A (karbon grubu) | 4 |
| 5A (azot grubu) | 5 |
| 6A (oksijen grubu) | 6 |
| 7A (halojenler) | 7 |
| 8A (soygazlar) | 8 |
Tablodan da anlaşılacağı gibi periyodik tablodaki grup sayısı ile değerlik elektron sayısı birbirinin aynısıdır.
DeÄŸerlik Elektronların Özellikleri
DeÄŸerlik elektronlar bir atomdaki en yüksek enerjili atomlardır. Lewis nokta yapısıyla gösterilirler. Bu elektronların önemli olmasının nedeni elementin yaptığı baÄŸlarla ilgili bize bilgi vermesidir.
AÅŸağıda soygazların deÄŸerlik elektron sayıları gösterilmiÅŸtir.
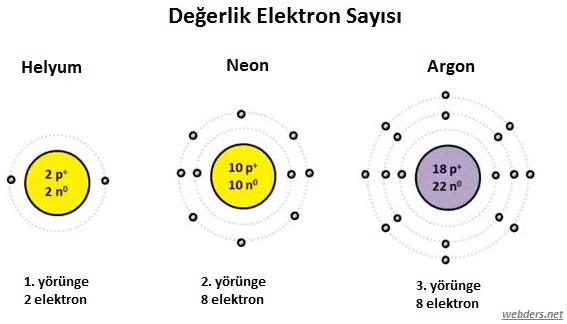
Tablodan görüldüÄŸü gibi soygazların deÄŸerliÄŸi 8'dir. Yani son yörüngedeki s ve p orbitalleri doludur. Böylece kararlı yapıdadır.
Bütün elementler soygazlar gibi kararlı yapıya geçmek isterler. Bu nedenle ya fazla elektronu verir, ya alır ya da ortaklaÅŸa kullanırlar.
ÖrneÄŸin alkali metaller s orbitallerindeki 1 elektronunu vererek kararlı yapıya geçerler. Bu nedenle bileÅŸiklerinde genellikle +1 deÄŸerlik alırlar.
Yine halojenler 7 olan deÄŸerlik elektron sayılarını tamamlamak için ya 1 elektron alırlar. Ya da baÅŸka bir atomla 1 elektronu ortaklaÅŸa kullanırlar. Bu sayede atomlar baÄŸ yaparak bileÅŸik oluÅŸturur.
Elektron alış verişi ile iyonik bağ, elektron ortaklaşmasıyla ise kovalent bağ oluşur.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
