Molalite Formülü ve Özellikleri
Kimyada karışımları incelerken en çok derişimlerini bakarız. Derişimleri değerlendirmek için ise çeşitli ölçüm birimleri vardır. Bunlardan en yaygını molaritedir. Ayrıca molalite dediğimiz kavram ile de derişim ölçülmesinde çok önemlidir. Bu yazıda molalite nedir öğrenecek, molalite formülü ve özellikleri üzerinde duracağız.
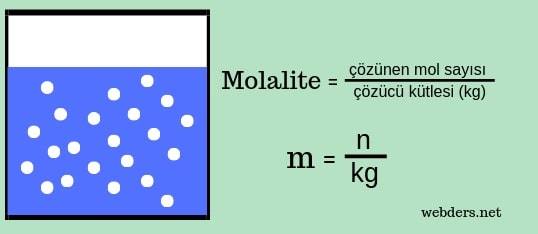
Molalitede dikkat etmek gereken şey çözeltinin kütlesi değil çözücünün kütlesi esas alınır. Örneğin 1 kg suda 1 mol şeker çözerseniz bu çözeltinin derişimi 1 molal olur. Molalitede derişimi ifade etmek için "molal" ifadesi kullanılır ve molalite "m" harfiyle gösterilir. Doğal olarak birimi de mol/kg şeklindedir.
Bir kilogram çözücü içerisinde çözünmüş maddenin mol sayısına molalite denir. Molalite terimi yerine sorularda kısaltma olarak ”molal” kelimesi kullanılır. Molalite “mˮ ile gösterilir. Molalitenin birimi mol/kgʼdır.
Molalite formülü molalite = çözünen mol sayısı / çözücü kütlesi (kg) şeklindedir.
Bu formülü uygulamak için hemen basit bir örnek yapalım.
Örnek: 32 gram SO2 bileşiği 400 gram çözücüde çözünmektedir. Elde edilen 432 gramlık çözeltinin derişimi kaç molal olarak bulunur? (S: 32, O:16)
Çözüm: Öncelikle bize verilen atom ağırlıklarından SO2'nin mol ağırlığını 32 + 2.16 = 64 olarak bulalım. 1 mol SO2 64 gram olduğuna göre 0,5 mol SO2 0,5 mol olur. Mol sayısını bulduk şimdi de çözelti kütlesini kg olarak ifade edelim. 400 gram 0,4 kg eder. Bu durumda molalite m = 0,5 / 0,4 = 1,25 olarak bulunur. Dikkat ederseniz formülde çözelti değil çözücünün kütlesi kullanılmıştır.
Molalite Soru Çözümü
Molalitenin temel formülünü öğrendik. Bazen karşımıza molalite yoğunluk formülü ile ilgili sorular da gelir. Bu durumda soruyu basit hale getirerek temel formülü kullanmak daha mantıklıdır.
Çözeltinin yoğunluğu verilmişse d = m / V formülünden kütle bulunabilir. Bulunan kütle ile de mol sayısı bulunur. Ardından yapılan işlemler devam eder. Şimdi bazı örnek sorular üzerinden konuyu daha iyi anlamaya çalışalım.
Soru #1: 1000 gram suda 71 gram Na2SO4 çözülerek bir çözelti hazırlanıyor. Çözeltinin molalitesini ne olur? (Na2SO4 : 142 g/mol)
A) 0,25
B) 0,5
C) 0,65
D) 1
E) 1,5
Çözüm: Formülü uygulamak için mol sayısını ve çözelti kütlesini tespit etmemiz gerekir. 1000 gram çözücü 1 kg demektir. Mol sayısı da n = m / MA ile bulunur. Yani 71 / 142 = 0,5 mol elde edlir. Öyleyse m = 0,5 / 1 = 0,5 molal bulunur. Cevap B seçeneğidir.
Soru #2: Kütlece derişimi %40 CaBr2 çözeltisindeki Br- iyon derişimi kaç molaldir? (CaBr2 : 200 g/mol)
A) 3,33
B) 4,45
C) 6,66
D) 7,5
E) 8
Çözüm: Soruda kütle verilmemiş ancak kütlece derişim verilmiştir. Öyleyse işlem kolaylığı olsun diye toplam çözelti kütlesini 1000g olarak kabul edebiliriz. Çözelti %40'lık olduğuna göre 400 gram çözünen, 600 gram ise çözücü vardır.
400 gram CaBr2 400 / 200 = 2 mol olarak bulunur. Çözücü kütlesi de 600 gram yani 0,6 kg olur. Öyleyse molal derişim m = 2 / 0,6 = 3,33 bulunur. Ancak şuna dikkat etmek gerekir. Soruda CaBr2 derişimi 3,33 molal olmasına rağmen Br- iyon derişimi farklı olur. Çünkü CaBr → Ca+2 + 2Br- şeklinde iyonlaşır. Öyleyse katsayıdan dolayı Br- iyon derişimi de 2 x 3,33 = 6.66 bulunur. Doğru cevap C seçeneğidir.
Soru #3: 500 gram çözücüye sofra tuzu (NaCI) eklenerek 1 molal derişime sahip çözelti hazırlanmak istiyor. Buna göre kaç gram tuz eklenmelidir (NaCI : 58 g/mol)
A) 9,5
B) 14,4
C) 19
D) 29
E) 58
Çözüm: Formülü aynen uygulayalalım. Çözücü kütlesi 500 gram olduğuna göre 0,5 kg şeklindedir. 1 = n / 0,5 ⇒ 0,5 mol bulunur. 1 mol NaCI 58 gram olduğuna göre 0,5 mol NaCI 29 gram şeklindedir. Doğru cevap D şeklindedir.
Diğer Bazı Derişim Formülleri
İşimize yarayabilir diye diğer derişim formüllerini de kısaca paylaşalım.
Molarite = M = Çözünen maddenin mol sayısı / Çözeltinin hacmi (Litre) ⇒ M = n / V
Kütlece yüzde (%) derişim = (Çözünenin kütlesi / Çözeltinin kütlesi) x 100
Hacimce yüzde (%) derişim = Çözünenin hacmi / Çözeltinin hacmi) x 100
Mol kesri = İstenilen maddenin mol sayısı / toplam mol sayısı ⇒ nA / ntoplam
ppm (Milyonda Bir Kısım) = ppm = (çözünenin kütlesi / çözeltinin kütlesi) x 106
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
