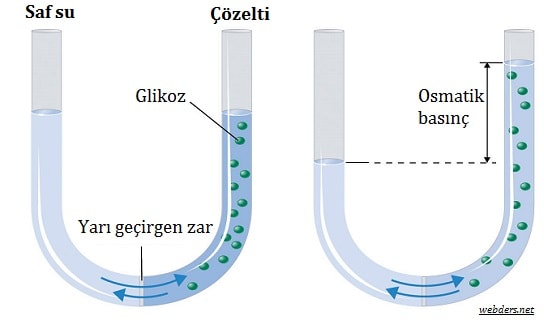
Osmotik Basınç Nedir?
Osmotik basınç kimya ve biyoloji için önemli bir konudur. Aslında basınç ve difüzyon ile akalakı bir konu olduğu için kimyanın konusudur. Ancak biyolojide de karşımıza çıkmaktadır. Çünkü hücrelerin su alıp vermesi bu prensibe göre olmaktadır.
Daha önce osmoz denir adlı yazıda osmozun ne olduğunu anlattık. Suyun difüzyonuna yani yayılması osmoz denir. Bu yazıda da osmotik basınç nedir sorusunu cevaplayacağız.
Bu ortam genellikle yarı geçirgen özellik taşır. En çok karışımıza çıkan haliyle de canlı hücresidir. Canlı hücrelerinde çözünmüş organik madde arttıkça su ihtiyacı artar. Bu ihtiyaç maddelerin çepere baskı yapması sonucunu doğurur. Bu basınç sayesinde hücre içerisine su alır.
Osmotik Basınç Formülü
Osmotik basınç formülü genel gaz denklemine benzerdir. P osmotik basınç olmak üzere
P = n.R.T / V osmatik basıç formülüdür. Burada n / V molar kütle olduğu için bunun yerine M yazarsak P = M.R.T olur. Burada
- P osmatik basınç
- n mol sayısı
- R ideal gaz sabiti (0.0821 L atm / mol K)
- T sıcaklık
- V çözelti hacmi
- M ise çözeltinin molar derişimidir.
Formülden kolaylıkla osmotik basıncı arttıran ve azaltan olaylar çıkarılabilir:
- Molar derişimin artması osmatik basıncı arttır. Düşmesi azaltır.
- Sıcaklığın artmasıyla osmotik basınç artar. Çünkü moleküllerin kinetik enerjisi ve hareketi artar.
- Hacmin artması derişimi azaltacağından osmotik basıncı azaltır.
Osmotik Basınç ve Turgor Basıncı Arasındaki İlişki
Nasıl osmotik basınç çözülmüş maddelerin çepere yaptığı basınçsa, turgor basıncı da suyun çepere yaptığı basınçtır. Dolayısıyla suyun azlığında osmotik basınç yüksek olurken, suyun çokluğunda ise turgor basıncı yüksek olur.
Öyleyse bu iki basıncın birbirinin zıttı olduğunu söyleyebiliriz. Osmotik basınç ve turgor basıncı arasındaki fark emme kuvvetini verir.
Emme kuvveti hücreye veya yarı geçirgen zarlı ortama su girmesini sağlayan net kuvvettir.
Emme kuvveti 0'dan büyük olursa hücre su alır. Eğer 0'a eşitse denge durumu vardır. Buna osmotik denge denir. Emme kuvveti 0'dan küçükse hücre su kaybeder.
Osmotik Basınç Soruları
Osmatik basınçla ilgili çeşitli sorular karşımıza çıkabilir. Örnek soru ve çözümlerle konuyu pekiştirelim.
Soru: Aşağıdakilerden hangisi bir hücrede osmotik basıncın artması ile birlikte ortaya çıkmaz?
A) Hücrenin emme kuvveti artar.
B) Hücrenin turgor basıncı düşer.
C) Hücre plazmoliz olur.
D) Hücre şişer.
E) Hücre içi yoğunluk artar.
Çözüm: Soruda osmotik basınç artarsa bir hücrede olması beklenenler sorulmuştur. Osmatik basınç artışıyla birlikte hücrenin emme kuvvet artar ve hücre büzülür. Bu durumda plazmoliz gerçekleşir ve turgor basıncı düşer. Hücre içi yoğunluk da elbette artar. Ancak hücre şişmez. Hücrenin şişmesi için hücrenin su alması gerekir. Hücre su aldığında osmatik basınç düşer. Cevap D seçeneğidir.
Soru: 20 °C'de 0.10 M Na3PO4 çözeltisinin osmotik basıncı ne olur?
A) 6,7 atm
B) 7,2 atm
C) 7,6 atm
D) 8,4 atm
E) 9,6 atm
Çözüm: Bu soruda osmotik basınç formülünü kullanacağız. Formüle göre P = M.R.T olur. Na3PO4 bileşiği 3Na+ ve PO4- şeklinde iyonlaşır. Yani 1 mol için 4 mol madde çözünür. Bu durumda molarite 0.10 x 4 = 0.40 bulunur. Formüldeki R sabit ve 0.0821 şeklindedir. Sıcaklığı da Kelvin cinsine çevirirsek 20 + 273 = 293 olur. Bu durumda (0.40)(0.0821)(293) = 9.6 atm bulunur. Doğru seçenek E seçeneğidir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
