İzotop Nedir?
Kimyada atom ve elementler açısından en önemli kavramlardan biri izotop kavramıdır. İzotop atomlara kimyanın her alanında rastlarız. Bu yazıda izotop nedir, kimyada nasıl karşımıza çıkar gibi konulara değineceğiz.
Bildiğimiz gibi kimyada periyodik tabloda elementler gösterilir. Her elementi oluşturan atom tek çeşittir. Bir atomun proton sayısı ve nötron sayısının toplamı bize kütle numarasını vermektedir.
Bir atomu diğerinden ayıran en temel özellik atom numarası yani proton sayısıdır. Bir atomun proton sayısı değişirse o atom temel özelliğini kaybeder ve başka bir atoma dönüşür.
Ancak aynı proton sayısına sahip birden fazla atom bulunabilir. Bu atomların nötronları farklıdır. Bu nedenle aynı atom gurubunda yer alırlar. Sadece aynı atomun izotopları olarak adlandırılırlar.
İzotoplar bir elementin farklı formları olarak düşünülebilir. Örneğin karbon atomunun 6 protonu ve 6 nötronu vardır. Ancak doğada 6 proton ve 8 nötron bulunduran 14C denilen ağır karbon da vardır. Doğada bulunan bütün karbon izotoplarının ortalama kütleleri o elementin kütlesi olarak geçmektedir.
Şunu da belirtelim ki izotop atomların elektron sayısı arasında bir fark yoktur. Çünkü nötr atomlarda proton sayısı ile elektron sayısı arasında fark yoktur. Ancak izotoplar iyona dönüşürse o zaman elektron sayısı eşitliğinden söz etmemiz mümkün olmaz.
İzotop Atomların Doğada Bulunma Yüzdeleri
Doğada bulunma yüzdeleri izotop atomlar için çok önemlidir. Çünkü hangisini ana atom olarak alacağımıza bu durum karar verir.
Yine aynı örnek üzerinden gidersek 12C ve 14C atomlarının her ikisi de karbon elementi olarak anılır. Bunlardan 12C izotop 14C izotopundan daha fazla bulunur. Karbon 12 sabit izotop, karbon 14 ise radyoaktif izotop olarak bilinir.
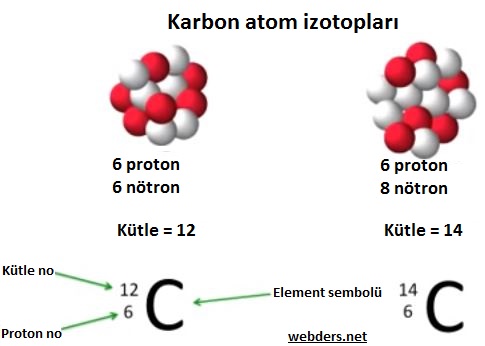
Bir elementin ortalama kütlesi hesaplanırken doğada bulunma oranları baz alınır. Yani bulunma yüzdeleri ile ağırlıklı ortalama alınır. Bu nedenle örneğin karbon atomunun ortalama kütlesi 12,01 olarak bilinir.
Periyodik tabloda sadece sabit 81 elementin 275 doğal izotopu bulunmaktadır. Ancak radyoaktif özellik taşıyan ve laboratuvarda üretilmiş sentetik izotop sayısı 800’den fazladır. Bütün bu izotopların doğada bulunma yüzdeleri birbirinden farklıdır.
Eğer bir atomda nötron sayısı proton sayısından fazla olursa bu element gittikçe kararsız bir yapı kazanır ve parçalanması daha kolay hale gelir. Bir element için kararlı izotop bölünmesi daha zor olan atom manasına gelmektedir.
Bir atoma proton sayısı sabit kalacak şekilde nötron ekler ya da çıkarırsanız o atomun izotopunu elde edersiniz. Bu şekilde sentetik olarak elde edilen radyoaktif izotoplar mevcuttur.
İzotop Atom Örnekleri
Yukarıda değindiğimiz gibi birçok izotop atom örneği vardır.
Örneğin 5 protonu ola bor elementi için 10B izotopunun doğada bulunma yüzdesi yaklaşık %20, 11B atomunun bulunma oranı ise yaklaşık %80’dir. Birinin nötron sayısı 5’ken diğerinin 6’dır.
Ağırlıklı ortalama alındığında 11B daha fazla olduğundan borun ortalama atom kütlesi 10,8 olarak kabul edilir.
Yine magnezyum elementinin 12 protonu olduğu bilinmektedir. Magnezyumun yaygın bulunan 3 tane izotopu vardır. 24Mg %79, 25Mg %10 ve 26Mg %11 yüzdeleriyle doğada bulunur. Magnezyumun ortalama atom kütlesi bu oranlarla 24,3 olarak ortaya çıkmaktadır.
Her atomun bu şekilde dağılımla izotopları görülmez. Örneğin sodyumun doğal izotopu yoktur ya da yok denilecek kadar azdır. Bütün sodyumlar 23Na formunda 11 proton ve 12 nötron içerirler. Bu nedenle sodyumun atom kütlesi 23 olarak görülebilir.
Bazı izotop atom örneklerinde bir izotop yüzde 99 ve üzerinde görülürken diğer izotop önemsiz sayılacak kadar az görülür. Periyodik tabloda bu tür izotop örnekleri oldukça yaygındır.
İzotop Atomlar İlgili Sorular
Öğrendiğimiz bilgiler ile ilgili birkaç soru çözerek konuyu pekiştirmeye çalışalım. Böylece öğrendiklerimiz kalıcı hale getirmiş oluruz.
Soru 1: Aşağıdakilerden hangisi 2040X atomunun izotoplarından biridir?
A) 2140X
B) 1941X
C) 2041X
D) 2141X
E) 2239X
Çözüm: İzotop atomların atom numaraları aynı ancak kütle numaraları ve nötron sayıları farklıdır. C seçeneğinde verilen atom X atomunun izotopudur. Çünkü atom numaraları eşit ve kütle numaraları farklıdır.
Soru 2: X atomunun ağır izotopu olan 25X doğada %20 ve daha hafif izotopu olan 24X %80 oranında bulunmaktadır. Buna göre X elementinin ortalama atom kütlesi ne kadardır?
A) 24,2
B) 24,6
C) 24,8
D) 25,0
E) 25,2
Soruda ağırlıklı ortalama almamız gerekmektedir. Öyleyse kütleleri bulunma yüzdeleriyle çarpmamız gerekir. 24.0,8 + 25.0,2 = 24,2 bulunur. Yani cevap A seçeneğidir.
Son olarak şu notu verelim. İzotop, izoton ve izobar kavramlarını birbirine karıştırmamak gerekir. İzoton proton sayıları farklı fakat nötron sayıları aynı olan, izobar ise kütle numaraları aynı olan farklı atomlar demektir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
