Lewis Elektron Nokta Yapısı
Lewis yapısı ya da Lewis elektron nokta yapısı kimyasal bağları göstermek için kullanılır. Bağ kurulurken eşleşmeyen elektronlar da nokta ile gösterilir. Kovalent bağlı molekülleri çizerken Lewis nokta yapısı ile gösterim yapmak işimizi kolaylaştırır.
Lewis Yapısının Temelleri
Lewis yapısı moleküller arasındaki bağların kısaltma gösterim şekillerinden biridir. Atomlar element sembolleri kullanılarak yazılır. Kimyasal bağları belirtmek için ise atomlar arasında çizgiler çizilir. Tek çizgi tekli bağ demektir. Çift çizgiler çift bağdır. Üçlü çizgiler üçlü bağlardır. (Bazen çizgiler yerine çift nokta kullanılır). Bağlanmamış elektronları göstermek için atomların yanına nokta konur. Yan yana iki nokta eşlenmemiş elektron çifti demektir.
Lewis Yapısının Kurulması
Lewis yapısını kurarak bir kimyasal molekülü simgesel olarak gösterebiliriz. Bunu yaparken aşağıdaki adımları takip ederiz.
Merkez Atomun Seçilmesi
Lewis nokta yapısının ilk adımıdır. Molekülün içerisindeki merkez atom seçilir. Merkez atom sayısı az olan ve bağa temel oluşturan atomdur. Örneğin CO2 molekülünde C merkez atom olarak ele alınır. Merkez atom elektronegativitesi en düşük olandır. Çünkü elektronegativitesi düşük olanın elektron koparma eğilimi daha yüksektir. Merkez atomu belirlemede zorluk çektiğimizde periyodik tabloya bakmamız gerekir. Periyodik tabloda soldan sağa gittikçe elektronagetivite yükselir. Bu nedenle soldaki atomun elektronegativesi genellikle daha düşük olur.
Merkez atomu yerleştirdikten sonra bunla bağ yapan atomları da etrafına yazarız. İki elektron ortaklaşması iki bağ demektir. Tek elektron ortaklaşması ise tek bağdır. Aynı örnek üzerinden devam edersek CO2 molekülünde her bir O atomu iki bağ yapacaktır. Çünkü oksijen atomu 6A grubundadır ve soygaza benzemek için iki elektron ihtiyacı vardır.
Elektronların Sayılması
Lewis elektron nokta yapısında her bir atom için değerlik elektronlarını göstermek gerekir. Değerlik elektron sayısı en büyük yörüngedeki elektron sayısıdır. Elektron sayısından önemli olan şey değerlik elektron sayısıdır. Oktet kuralı buradaki temel kuraldır. Örneğin oksijenin 6 elektronu karbonun ise 4 elektronu oktetini tamamlamak ister. Oksijenin etrafına 6 nokta karbonun etrafına 4 nokta koyarız.

Merkez bütün elektronları paylaşma eğiliminde olduğu için burada boşta elektron kalmadığına dikkat etmek gerekir.
Yapının Tamamlanması
Elektronlar yerleştirildikten sonra bağlar kurulur. Her atomdan birer elektron olmak üzere 2 elektron 1 bağ demektir. 4 elektron ise 2 bağ anlamına gelir. Çevre atomlardan bağa katılmayan elektron çiftlerini nokta yapısı ile gösteririz.
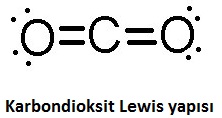
Böylece Lewis elektron nokta yapısıyla bir molekülün içerdiği tekli, ikili ve üçlü bağları görürüz. Bununla birlikte ortaklaşa kullanılmayan elektronlar da Lewis yapısında bulunur.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
