Kaynama Noktası Yükselmesi
Karışımlar saf madde olmadıkları için bazı özelliklerinde farklılık görülür. Çözeltilerin derişimine bağlı bu özelliklerine koligatif özellikler denir. Koligatif özellikler genel olarak 4 başlık altında incelenir:
- Buhar basıncı alçalması
- Kaynama noktası yükselmesi
- Donma noktası alçalması
- Ozmotik basınç
Bu yazıda bunlardan kaynama noktası yükselmesi üzerinde duracağız. Çözeltide derişime bağlı olarak çözünen kaynama noktasının artmasına kaynama noktası yükselmesi denmektedir.
Kaynama noktasının artması aslında buhar basıncının düşmesiyle alakalıdır. Uçucu olmayan çözücü buhar basıncını düşürmektedir. Kaynama demek buhar basıncının atmosfer basıncına eşit olması demektir. Buhar basıncı düştüğü için karışımın kaynama noktasına ulaşması daha uzun sürecektir. Bu da kaynama noktasını arttıracaktır.
İlgili yazı: Buhar basıncı alçalması
Kaynama Noktası Yükselmesi Formülü ve Soruları
Kaynama noktası yükselmesini bulmak için ΔTk = Tk - Tko formülünü kullanabiliriz. Burada Tk çözeltinin kaynama noktası, Tko ise çözücünün saf halinin aynı sıcaklıktaki kaynama noktasıdır.
Örneğin normal şartlar altında 100 °C'de kaynayan suya belli maddeler ekleyip de kaynama noktasını 101,5 °C'ye çıkarırsak burada kaynama noktası yükselmesi 101,5 - 100 = 1,5 °C bulunur.
Şimdi ana mesele çözeltinin kaynama noktasını bulmaktır. Saf maddenin kaynama noktası soruda zaten verilecektir.
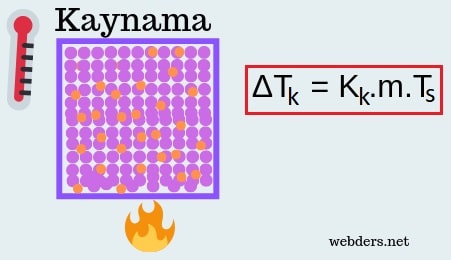
ΔTk = Kk.m.Ts burada Kk kaynama noktası yükselmesi sabitidir. Ts ise çözeltideki tanecik sayısıdır. Yine m çözeltinin molalitesidir. Molalitenin nasıl hesaplandığını molalite formülü yazısında anlatmıştık.
Soru: 1000 gram su içerisinde 117 gram sofra tuzu ekleniyor ve tamamı çözünüyor. Çözeltinin kaynama noktası saf suya göre kaç °C artar? (NaCl: 58,5 g/mol su için Kk = 0,52)
A) 1,68
B) 2,08
C) 2,42
D) 2,96
E) 3,32
Çözüm: Önce molaliteyi hesaplayalım. Molalite için mol sayısı ve çözücünün kütlesine ihtiyaç vardır. Mol sayısı 117 / 58,5 = 2 bulunur. Çözünün kütlesi ise 1kg şeklindedir. Öyleyse molalite 2 / 1 = 2 bulunur. Burada dikkat edilmesi gereken şey NaCI yani sofra tuzunun Na ve CI iyonlarından dolayı tanecik sayısın 2 olmasıdır.
Formülü uygularsak 2.2.0,52 = 2,08 bulunur. Cevap B seçeneğidir.
Kaynama Noktası Yükselmesi Nelere Bağlıdır?
Kaynama noktası yükselmesi nelere bağlıdır anlamak için formülüne bakmak gerekir. En başta Kk denilen kaynama noktası yükselmesi sabiti burada önemli rol oynamaktadır. Bunun dışında ikinci faktör katılan maddenin miktarıdır. Son faktör de katılan miktarın iyonlaştığında ortaya çıkardığı tanecik sayısıdır.
Kaynama noktası yükselmesi için günlük hayattan örnek vermek istersek tuz katılmış suyun veya şekerli suyun normal sudan daha geç kaynamasını örnek verebiliriz. Koligatif özellikler için deney yapmak mümkündür.
Kaynama noktası yükselmesi için deney yapacaksanız önce saf bir suyu ocakta kaynatıp kaynamaya ulaştığı anda sıcaklığını termometreyle ölçün. Ardından aynı miktar suya bir miktar şeker veya tuz ekleyerek tekrar kaynatın. Aradaki farkı göreceksiniz zaten. Eklediğiniz tuz veya şeker miktarıyla ilgili hesaplama yaparak suyun kaynama noktası yükselmesi sabitini tespit edebilirsiniz.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
