Atom Modellerinin Tarihsel Gelişimi
Atomun küçük ve bölünemez parçacıklardan oluştuğu fikrini ilk olarak yunanlı filozof Democritus (M.Ö. yaklaşık 460-370) ortaya atarak bu parçacıklara Yunanca bölünemez manasına gelen "atom" ismini vermiştir. Atom nedir adlı yazıda atomun tanımını ve özelliklerini vermiştik. Şimdi de atom modellerinin tarihsel gelişimi üzerinde durarak atom ile ilgili bilgilerimizin kaynağını görelim.
Atomun tarihsel gelişimi içerisinde atomla ilgili dört temel model ortaya konmuştur.
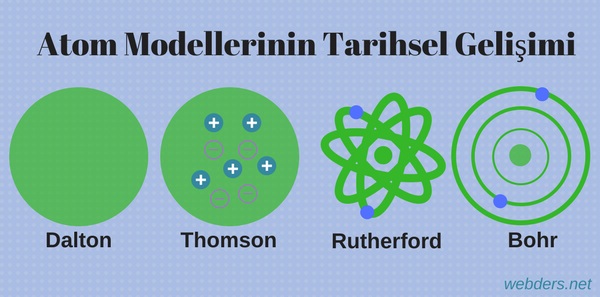
Dalton Atom Modeli
Dalton öne sürdüğü modelde;
- Madde, atom denilen içleri dolu küre şeklindeki parçalanmayan taneciklerden oluşmuştur.
- Bir elementin tüm atomları şekil, hacim, kütle açısından birbirinin aynı, farklı elementlerin atomları ise tamamen birbirinden farklıdır.
- Tepkimelerde atomlar korunur. şeklinde ifade etmiştir.
Dalton Atom Teorisindeki Eksiklik ve Yanılgılar
- Bir elementin bütün atomları aynı değildir. O dönemde nötron tanecikleri tespit edilemediği için izotop atomlardan bahsedilmemiştir.
- Atomlar içi dolu küre şeklinde değil boşluklu yapıya sahiptir.
- Günümüzde atom parçalanamaz ifadesi yanlıştır. Ayrıca bilinen en küçük parçacık atom değildir.
- Bir elementin bütün atomları aynı olmadığı gibi bir bileşiğin bütün molekülleri de aynı değildir.
Thomson Atom Modeli
Thomson, atomun düzgün olarak dağıtılmış pozitif yükler ve aralarında homojen bir şekilde bu yükü dengeleyen negatif yüklerden bulunduğunu ifade etmiştir.
Bu ifade ile atomu üzümlü keke benzetmiştir. Kek pozitif yükü, üzümler ise elektronları belirtmektedir.
Thomson yaptığı deneyle, gerilim uygulanan katot ışınları tüpündeki, katot ışınlarının pozitif kutup tarafından çekilirken negatif kutup tarafından itildiğini fark etti.
Katot ışın tüpü ile yapılan çalışmalar günümüz televizyonlarının hatası olarak kabul edilmektedir.
Atomun kütlesini protonlar oluşturur. Atom 10-1m çapında bir küredir.
Thomson Atom Teorisindeki Eksiklik ve Yanılgılar
Atomun yapısında (+) ve (-) yükler homojen bir şekilde dağılmış durumda değildir. Ayrıca atomdaki nötronların varlığını da açıklayamamıştır. Pozitif ve negatif yüklerin ortaya konması atom modellerinin tarihsel gelişimi açısından çok önemli bir basamaktır. Modeldeki eksikler daha sonraki modellerle giderilmiştir.
Rutherford Atom Modeli
Rutherford atom modelini elde etmek için radyoaktif bir element olan ve sadece alfa ışınımı yayan radyum elementini kullanmıştır.
Yaptığı deneyde oldukça ince altın bir levhayı alfa ışınları ile bombardıman etmiş ve sonuçta alfa ışınlarının çoğunun levhadan geçtiğini gözlemlemiştir.
Alfa taneciklerinin çoğu levhadan geçebildiğine göre atomun yapısında büyük boşluklar olması gerektiğini düşünmüştür. Ayrıca alfa taneciklerinden bazılarının yönlerinde sapmalar gözlenirken, bazılarının ise geri yansıdığını gözlemlemiştir. Bu yansıma ve sapmalar sayesinde atomun merkezinde artı yüklü bir çekirdek olması gerektiğini düşünen Rutherford kendi adı ile anılan bir atom teorisi ortaya atmıştır.
Rutherford Atom Teorisindeki Eksiklik ve Yanılgıları
Elektronun çekirdek etrafındaki yeri tam olarak ifade edilememiştir. Ayrıca elektronun neden çekirdeğe düşmediği ya da atomdan fırlayıp gitmediği sorusunu da açıklayamamıştır. Ancak çekirdek kavramını ortaya koyması açısından bu model çok önemlidir.
Bohr Atom Modeli
Niels Bohr atom kuramını hidrojenin yayılma spektrumu ve Planck'ın kuantum teoremini ele alarak oluşturmuştur. Atom fikrinin tarihi açısından bohr atom modeli çok önemlidir.
Bohr yaptığı gözlemlerde yayılan ışımaların atomlarda bulunan elektronların yer değiştirmelerinden dolayı oluştuğu düşünmüştür. Hidrojenin çizgi spektrumu ışımanın kuantlar halinde yayıldığını gösterir. Elektron yüksek enerjili bir düzeyden düşük enerjili bir düzeye geçerken, arasındaki enerji farkı ışıma kuantumu olarak yayılır ve yayılma spektrumundaki bir çizgiye karşılık gelir.
Bohr'a göre atomun bir çekirdek ve çevresindeki elektronlardan oluştuğunu ve bu elektronların çekirdek üzerine düşmediği durumundan yola çıkarak kendine ait atom modelini geliştirmiştir.
Elektronlar çekirdekten belirli uzaklıkta yörüngelerde bulunabilir.
Bu yörüngelerde elektronlar dairesel hareket yaparak bulunmaktadır. Yörüngelere aynı zamanda temel enerji düzeyi de denilmektedir. Bunlar K, L, M, N, O veya 1, 2, 3, 4, 5 gibi rakamlarla ifade edilmektedir.
Madde en düşük enerjili olduğu temel haldeyken yapısına enerji verildiğinde daha yüksek enerjili duruma geçmek ister. Bu duruma da uyarılmış hal denir.
Yüksek enerjili elektronlar daha kararlı hale geçmek için düşük enerji seviyesine geçerler ve yapılarında bulunan enerjileri ışın olarak yayarlar. Çekirdeğe yakın olan elektronların enerjisi daha düşüktür. Bunu da yakın olan elektronların enerjisi negatif olmasından anlıyoruz.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
