Dipol Dipol Etkileşimi
Kimyasal türler arası etkileşimlerden biri de dipol dipol etkileşimi dediğimiz kuvvettir. Bu tür kuvvetler moleküller arası kuvvet olduğu için kimyada zayıf etkileşimler olarak adlandırılır. Şimdi dipol nedir bilmeyenler için basitçe anlatıp kafanızda bazı şeylerin daha iyi oturmasını sağlayalım.
Bir polar molekülün pozitif ucu ile başka bir polar molekülün negatif ucu arasındaki çekici kuvvetler de diyebiliriz. Dipol dipol kuvvetleri, mol başına 5 kJ ile 20 kJ arasında değişen etkiye sahiptir.
Atomlar arası bağlar olan iyonik ve kovalent bağlardan çok daha zayıftırlar. Bu nedenle moleküller sadece birbirine yakın olduklarında etkili olabilirler. Bu konu hakkında bilgi sahibi olmak isteyen insanların ilk bilmesi gereken bilgi dipol dipol etkileşimin polar mı apolar mı olduğudur. Bu etkileşimler polar moleküller arasında görülmektedir.
Dipol Dipol Etkileşimi İçin Örnek
Dipol dipol etkileşimi hangi moleküller arasında oluşur öğrendik. Şimdi de bunlara biraz örnek verelim.
HCI, H2O, ICI, NH3, C3H8O gibi polar moleküller arasında dipol dipol etkileşimleri görülmektedir.
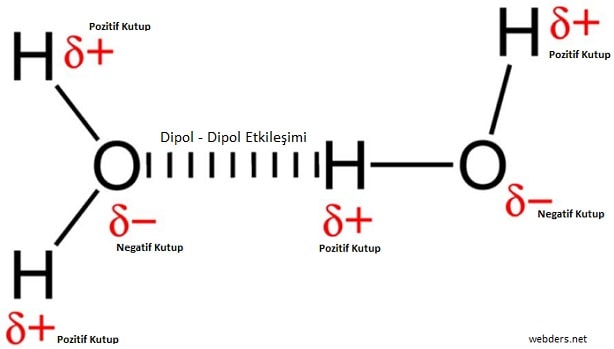
Dipol dipol kuvvetlerinin özelliklerini şöyle sıralayabiliriz:
- Polar moleküllerinin zıt kutupları arasında çekim gerçekleşir.
- Polar moleküllerde bir taraf kısmi pozitif yüklenmişken diğer taraf kısmi negatif yüklenmiştir.
- Polarlık arttıkça dipol dipol etkileşimi de artar.
- Sıcaklık yükseldikçe bu etkileşim de düşer.
- Polar moleküller bu etkileşim sayesinde birbiri içerisinde iyi çözünür.
Moleküller Arası Diğer Etkileşimler
Kimyasal etkileşimler içerisinde zayıf etkileşimler şöyle sıralanabilir:
- Van der Waals bağları
- Hidrojen bağları
Bunlardan hidrojen bağlarını ayırırsak eğer Van der Waals bağları da kendi içerisinde dipol dipol, iyon dipol, indüklenmiş dipol - indüklenmiş dipol şeklinde sınıflandırılabilir. İndüklenmiş dipol - indüklenmiş dipol bağları London Kuvvetleri olarak da adlandırılır. Bu da apolar moleküller arasında görülen bir etkileşimdir.
Moleküler arası etkileşimler kimyasal bileşiklerde birçok faktörü etkilemektedir. Maddelerin birbiri içerisinde çözünmesinden tutun da kaynama ve erime noktası bunlarla ilişkilidir. Örneğin polar maddelerin molar çözücülerde, apolar maddelerin ise apolar çözücülerde çözünmesinin en önemli nedeni budur.
Yine hidrojen bağı içeren maddelerin kaynama noktasının yüksek olması hidrojen bağının zayıf etkileşimler içerisinde nispeten daha kuvvetli olmasından kaynaklanmaktadır. Alkollerin eterlerden daha yüksek kaynama noktasına sahip olmasının ana nedeni hidrojen bağının dipol dipol etkileşimine baskın gelmesidir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
