Zayıf Etkileşimler
Atomları ve molekülleri bir arada tutan etkileşimler söz konusudur. Kimyasal türler arası etkileşimler, güçlü etkileşimler ve zayıf etkileşimler şeklinde ikiye ayrılmıştır. Bu yazıda zayıf etkileşimler üzerinde duracağız. Zayıf etkileşimler ilgili konu anlatımda detaylı bir şekilde anlatılmıştır. Zayıf etkileşimlere fiziksel etkileşim veya fiziksel bağ da denir.
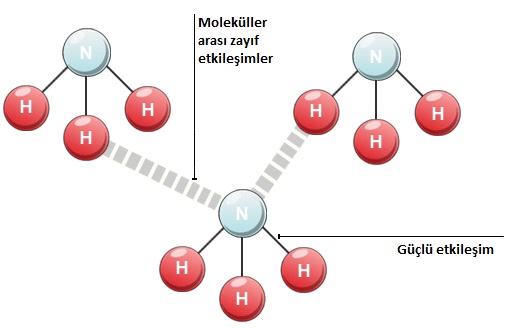
Kimyada atom arasında var olan bağlar kimyasal bağdır ve güçlüdür. Ancak moleküller arasında bulunan bazı kuvvetler zayıf etkileşim olarak sınıflandırılır.
Zayıf etkileşimleri basitçe ikiye ayırabiliriz:
- Van der Waals etkileşimleri
- Hidrojen etkileşimleri
Van der Waals Etkileşimleri
Van der Waals bağları ya da diğer bir deyişle Van der Waals etkileşimleri fiziksel bağların en bilinenleridir. Hidrojen bağı dışında kalan zayıf etkileşimlerin tümü Van Der Waals bağıdır. Van der Waals etkileşimleri şöyle sınıflandırılabilir:
- Dipol-dipol bağları
- İyon-dipol bağları
- İndüklenmiş dipol bağlar
- İyon-indüklenmiş dipol bağlar
- Dipol-indüklenmiş dipol bağlar
- London kuvvetleri (indüklenmiş dipol-indüklenmiş dipol)
Dipol ve İndüklenmiş Dipol Kavramları
Kimyasal bağlar oluşurken atomlar arasındaki çekim kuvveti farkından dolayı bazen polar moleküller oluşur. Polar kovalent bağlar kutupludur ve kalıcı dipol karakter gösterir. HCl ve HBr gibi moleküller polardır.
Normalde apolar olan moleküllerin kutupsuz olması beklenir. Ancak elektronların herhangi bir anda atomun veya molekülün bir bölgesine yığılma olasılığı vardır. Böyle bir olasılıkta apolar molekül polar özellik gösterir. Bu şekilde ortaya çıkan dipol karaktere ise indüklenmiş dipol denir.
Özetle şöyle diyebiliriz. Polar moleküllerde kalıcı dipol, apolar moleküllerde ise indüklenmiş dipol oluşur.
Van der Waals etkileşimleri dipol, indiklenmiş dipol ve iyonlar arasında meydana gelen etkileşimlerdir. Bu yapıların ikili etkileşimleri farklı karakter taşır. Yukarıda verdiğimiz sınıflandırma Van der Waals etkileşimlerini özetlemektedir.
Hidrojen Etkileşimleri
Hidrojen bağları ya da hidrojen etkileşimleri zayıf etkileşimlerin bir diğer türüdür. Hidrojen bağı sadece hidrojen içeren moleküllerde meydana gelir. Eğer molekülde flor gibi elektronegaifliği yüksek bir atom varsa hidrojen kısmi olarak pozitif yüklü özellik gösterir. Bu pozitiflik diğer moleküller ile etkileşim meydana getirir. Bu etkileşime hidrojen bağı denir.
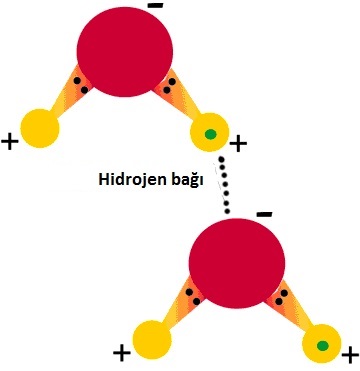
Hidrojen bağı zayıf etkileşim olmasına rağmen Van der Waals etkileşimlerine göre yaklaşık olarak 10 kat daha güçlüdür. Hatta bazı durumlarda hidrojen bağı güçlü etkileşim olan kovalent bağdan bile daha güçlü olmaktadır.
Zayıf Etkileşimlerin Kuvvet Sıralaması
Zayıf etkileşimler de kendi içerisinde daha güçlü ve daha zayıf olarak ayrılırlar. Zayıf etkileşimler için güç sıralaması yaparken önce hidrojen bağını alırız. Yukarıda da belirtildiği gibi hidrojen bağı Van der Waals bağlarından daha güçlüdür.
Van der Waals etkileşimleri içerisinde de kalıcı dipollerin daha güçlü etkileşim oluşturduğunu söyleyebiliriz. Çünkü bu moleküller sürekli polar karakterdedir.
Bir maddenin kaynama noktası yükseldikçe bu maddenin moleküler arası bağlarının kuvveti de artar. Çünkü güçlü bağlar için daha fazla enerji gerekmektedir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
