Katalizör Nedir?
Katalizör kimya ve biyoloji bilimini ilgilendiren önemli bir kavramdır. Katalizör nedir sorusuna yanıt vererek bu iki alana birden fayda sağlamış olacağız.
Katalizör reaksiyonda tüketilmediği için tekrar kullanılabilir. Katalizörün temel görevi aktivasyon enerjisini düşürüp kimyasal tepkimenin daha kolay gerçekleşmesini sağlamaktır.
Kimyasal Tepkimelerde Katalizör
Kimyasalların tepkimeye girmesi için, eski bağların kopması ve yeni bağların kurulması gerekir. Çünkü ürünlerdeki bağlar ile tepkimeye girenlerin kimyasal bağları farklıdır. Bağların yeniden düzenlenmesindeki en yavaş adım, bir "geçiş süreci" olarak adlandırılan basamak meydana getirir. Geçiş durumunda ne girenlerden ne de ürünlerden sayılamayacak bir ara ürün evresi meydana gelir.
Girenler ⇄ Geçiş süreci ⇄ Ürünler
Geçiş halini oluşturmak için enerji gereklidir. Bu enerjiye aktivasyon enerjisi veya Ea denir. Aşağıdaki diyagramın soldan sağa doğru okunması, tepkime maddelerinin ürün haline gelmesi için geçiş durumundan geçtikçe bir reaksiyonun ilerleyişini göstermektedir.
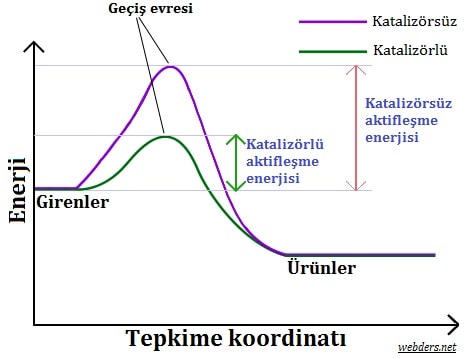
Grafikten anlaşıldığı gibi katalizörün temel görevi aktivasyon enerjisini düşürmektir. Aktivasyon enerjisinin düşmesi kimyasal tepkimeyi çok daha kolay hale gelmektedir. Çünkü tepkimeye girecek olan maddeler çok daha kolay gereken enerji seviyesini aşacaktır.
Katalizör ile Aktivasyon Enerjisini Aşmak
Aktivasyon enerjisi, kimyasal reaksiyona karşı bir bariyer olarak düşünülebilir. Reaksiyonun gerçekleşmesi için bu bariyerin aşılması gerekir. Bariyer yüksek ise, sadece birkaç molekül bariyeri geçebilecek yeterli kinetik enerjiye sahip olacaktır. Bu az sayıdaki molekül birbiriyle çarpışacak ve tepkimeyi meydana getirecektir. Ea'dan yani aktivasyon enerjisinden daha düşük enerjiye sahip olan reaktanlar, reaksiyona girmek ve ürün haline gelmek için geçiş halinden geçemezler.
Katalizör, reaksiyon için daha düşük Ea ile ilerleyen farklı bir yol sağlar. Katalizörler enerji bariyerini aşağı indirir. Tepkimenin rotasının değişmesi reaktifleri daha kolay bir şekilde, daha düşük bir enerji girişi ile ürünlere dönüştürmek için gerekli olan bağ düzenlemesine olanak sağlar. Belirli bir zaman aralığında katalizörün varlığı, reaktanlardan (tepkimeye girenlerden) daha büyük bir kısmının, geçiş durumundan geçmek ve ürün haline gelmek için yeterli enerjiyi toplamasına izin verir.
Örneğin hidrojen ve azottan amonyak elde etmek için gereken katalizör demirdir. Yani N2(gaz) + 3H2(gaz) ⇌ 2NH3(gaz) tepkimesi demir ile katalize edilir. Demir sayesinde bağlar daha kolay kırılıp yeni bağlar kurulur.
Enzimler
Katalizörlerin biyolojinin de konusu olduğunu söyledik. Enzimler biyolojik katalizörler olarak faaliyet gösterir.
Vücudumuzda ve diğer canlılarda, biyokimyasal reaksiyonları hızlandırmak için enzimler kullanılır. Enzim bir tür katalizördür. Tepkimelerin uygun hızlarda gerçekleşmesini sağlamak için enzimler üretilir. Enzimlerin şekilleri ve reaksiyona giren maddelere bağlanan kısımları, alternatif bir reaksiyon yolu sağlar. Böylece belirli moleküllerin bir araya gelip aktivasyon enerjisi bariyerini geçmesi kolay hale gelir.
Katalizörler bir kimyasal denge tepkimesinin mekanizmasını değiştiremez. Yani ileri ve geri tepkilerin her ikisi de hızlanır. Böylece denge sabit Kd değişmez.
Katalizörler tepkimeyi hızlandırır ancak başlatamaz. Dolayısıyla katalizörün temel görevi aktivasyon enerjisini düşürmektir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
