Aktivasyon Enerjisi Nedir?
Aktivasyon enerjisi hem kimya hem de biyoloji dersinde karşımıza çıkan bir kavramdır. Aktivasyon enerjisi nedir sorusunu birlikte yanıtlayalım.
Kimyasal tepkimelerin gerçekleşmesi için belirli bir enerji düzeyine ihtiyaç vardır. Bu enerji düzeyi sağlandığında tepkime gerçekleşmeye başlar. Tepkime endotermik ise ısı alarak ilerler. Tepkime ekzotermik ise de ısı açığa çıkarır. Ancak her iki durumda da tepkimenin başlaması için minimum bir ısıya ihtiyaç vardır.
Şimdi de aktivasyon enerjisi ve özellikleri hakkında biraz detay verelim.
Kimyada Aktivasyon Enerjisi
Kimyanın inceleme alanlarından biri de kimyasal tepkimelerdir. Özellikle kimyasal tepkimelerin gerçekleşme hızı aktivasyon enerjisi ile çok alakalıdır. Aktivasyon enerjisi kimyada Ea ile gösterilir.
Bir kimyasal tepkimenin gerçekleşmesi için çeşitli şartlar vardır. Örneğin reaksiyona giren maddelerin uygun geometride çarpışması gerekir. Bununla birlikte tepkimenin gerçekleşmesi için çarpışan moleküllerin aktivasyon enerjisini de geçmesi gerekir. Reaksiyona giren ve çıkan maddelerin potansiyel enerjileri arasında bir bariyer vardır. İşte bu bariyerin bir sonucu olarak aktivasyon enerjisi kavramı karşımıza çıkar.
"Aktivasyon enerjisi" terimi İsveçli bilim adamı Svante Arrhenius tarafından 1889'da ifade edilmiştir. Arrhenius denklemi aktivasyon enerjisini, bir kimyasal reaksiyonun ilerlediği hız ile ilişkilendirir. Buna göre k = Ae-Ea / (RT) eşitliği vardır.
Burada k reaksiyon hızı katsayısıdır, A reaksiyonun frekans faktörüdür, e irrasyonel bir sayıdır (yaklaşık 2.718'e eşittir), Ea aktivasyon enerjisi, R evrensel gaz sabiti ve T Kelvin cinsinden mutlak sıcaklıktır. Arrhenius denkleminden, reaksiyon gerçekleşme oranının sıcaklığa göre değiştiği görülebilir. Doğal olarak, bir kimyasal reaksiyonun daha yüksek bir sıcaklıkta daha hızlı ilerlediği buradan anlaşılabilir. Bununla birlikte, bir reaksiyon oranının sıcaklıkla azaldığı bazı "negatif aktivasyon enerjisi" durumu da vardır.
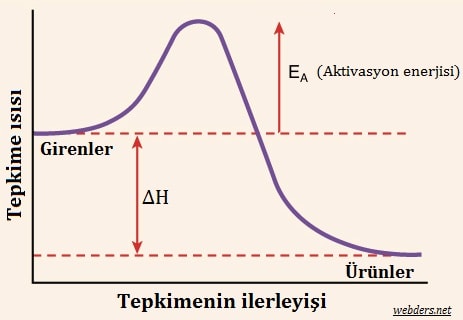
Yukarıdaki grafikte bir tepkimenin ilerleme sürecinde aktivasyon enerjisinin etkisi gösterilmiştir. Burada ΔH reaksiyonun entalpisidir.
Aktivasyon enerjisine bazen aktifleşme enerjisi de denir. Çünkü reaksiyonun aktif hale gelmesi, başlaması manasına gelmektedir. Çift yönlü tepkimelerde hem ileri yönde hem de geri yönde aktifleşme enerjisi vardır.
Biyolojide Aktivasyon Enerjisi
Biyolojide de aktivasyon enerjisini özellikle enzim konusunda görürüz. Enzimlerin ana işlevi işte bu aktivasyon enerjisiyle ilişkilidir. Çünkü enzimler katalizör görevi görüp kimyasal reaksiyonlar için gereken enerji miktarını düşürürler. Bu da reaksiyonların çok daha hızlı olmasını sağlar.
Canlılarda sürekli kimyasal reaksiyonlar gerçekleşir. Her reaksiyon için ise özelleşmiş enzim bulunur. Enzimler sayesinde bazen bir reaksiyon 100 bin kat daha hızlı yapılabilmektedir. Böyle düşünüldüğü zaman enzimler olmadan canlılığın olmayacağı da anlaşılır.
Aktivasyon Enerjisi Nasıl Düşürülür?
Aktivasyon enerjisini düşürmek, kimyasal tepkimenin çok daha hızlı ve kolay olmasını sağlamaktadır. Aktivasyon enerjisini düşüren faktörlere baktığımızda sadece katalizör kullanımının bu enerjiye etki ettiğini görüyoruz. Ancak reaksiyonu hızlandırmak için sıcaklığı arttırmak gibi yöntemler kullanılabilir.
Katalizörler tepkimeye özgüdür. Bu nedenle her katalizör her tepkimede kullanılmaz. Katalizörler genellikle tepkimeden etkilenmeden çıkar ve tekrar kullanılırlar. Enzimler canlılarda gerçekleşen tepkimelerde kullanılan biyolojik katalizörlerdir. Enzimlerin farklı görevlerinin olmasının nedeni tepkimeye özgü olmalarıdır.
Aktivasyon enerjisini düşürdüğümüz zaman bu enerjiyi geçen tanecik sayısını da arttırırız. Böylece reaksiyon da hızlanır. Ancak reaksiyon hızının artması sadece aktivasyon enerjinin düşürülmesiyle ile gerçekleşmez. Başka yöntemler de kullanılır. Aktifleşme enerjisini düşürmenin tek yolunun katalizör kullanımı olduğunu unutmamak gerekir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
