HNO3 (Nitrik Asit) Nedir?
Bu yazıda HNO3 bileşiği üzerinde duracağız. Amacımız bileşikle ilgili bilinmesi gereken temel bilgileri derli toplu bir şekilde sunmaktır.
Bileşiğin saf hali renksizdir ancak beklediğinde zaman içerisinde sarıya çalan bir renk alır. Piyasada bulunan çoğu nitrik asit çözeltisi suda %68 derişime sahiptir. Çözelti% 86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır.
Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %95'in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit veya kırmızı dumanlı nitrik asit olarak karakterize edilir.
Nitrik Asidin Fiziksel ve Kimyasal Özellikleri
Ticari olarak satılan nitrik asit çözeltisi, % 68 HNO3 içerir. Bu çözelti, 1 atmosfer basınçta 120,5 ° C kaynama sıcaklığına sahiptir.
Ticari ilgi alanına sahip olan nitrik asit, genellikle, yaklaşık% 68 HNO3 olan (yaklaşık 15 molar) nitrik asit ve sudan oluşur.
Konsantre nitrik asidin yoğunluğu ise 1.42 g/cm3’tür.
Nitrik asit sıcaklıkta ayrışmaya maruz kalır ve bu nedenle genellikle kahverengi cam şişelerde saklanır: 4HNO3 → 2H2O + 4NO2 + O2. Bu reaksiyon nitrik asidin ayrışma reaksiyonudur.
Azot dioksit (NO2), yüksek sıcaklıklarda sarı veya hatta kırmızı renkte olan nitrik asit içerisinde çözünmüş olarak kalır. Saf asit, havaya maruz bırakıldığında beyaz dumanları bırakma eğilimindeyken, çözünmüş nitrojen dioksit ile asit kırmızımsı-kahverengi buharları verir ve "kırmızı dumanlı asit" veya "dumanlı nitrik asit" e yol açar.
NO2 azot oksijen bileşiği örneklerinden biridir.
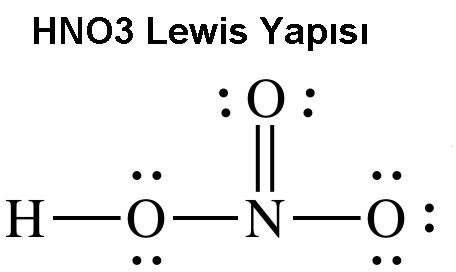
HNO3 Lewis Nokta Yapısı Gösterimi
Nitrik asidin bileşimindeki atomlar H, N ve O birere ametaldir. Bu nedenle içerdiği bütün bağlar kovalent bağdır.
İçerdiği atomların atom numaraları ise H = 1 N = 7 ve O = 8 şeklindedir. Bileşikte son yörüngeyi hidrojen 2’ye, oksijen ve azot ise 8’e tamamlamak isteyecektir.
Merkezde olan N atomuna üç oksijen bağlanacaktır. Oksijenlerden biri çiftli bağ yapacak, biri de diğer bir hidrojene bağlanacaktır.
HNO3’ün Lewis yapısı aşağıda gösterilmiştir.
HNO3 Reaksiyonları
Nitrik asit normalde ortam sıcaklığında güçlü bir asit olarak düşünülür. Asit ayrışma sabitinin değeri üzerinde birtakım anlaşmazlıklar vardır, ancak basınç cinsinden denge sabiti pKa değeri genellikle -1'den düşüktür. Bu, seyreltilmiş çözeltideki nitrik asidin son derece asitli çözeltiler haricinde tamamen ayrıştığı anlamına gelir. 250 ° C sıcaklıkta pKa değeri 1'e yükselir.
Nitrik asit sülfürik asit gibi güçlü bir asidin yanında baz görevi görebilir: HNO3 + 2H2SO4 ↔ NO2+ + H3O+ + 2HSO4-
HNO3 Elde Edilmesi
Nitrik asit, azot dioksitin (NO2) suyla reaksiyonuyla yapılır.
3NO2 + H2O → 2HNO3 + NO
Normalde, tepkime ile üretilen nitrik oksit, ilave nitrojen dioksit üretmek için havadaki oksijenle yeniden oksitlenir.
Hidrojen peroksit vasıtasıyla azot dioksit kabarcıkları asit verimini artırmaya yardımcı olabilir.
2NO2 + H2O2 → 2HNO3
Ticari nitelikli nitrik asit çözeltileri genellikle% 52 ila% 68 arasında nitrik asittir. Nitrik asit üretimi, Alman kimyager Wilhelm Ostwald'ın adını taşıyan Ostwald işlemi ile yapılır. Bu işlemde, susuz amonyak, yaklaşık 500 K'lik yüksek bir sıcaklıkta ve 9 barlık bir basınçta, platin veya rodyum gazlı katalizör varlığında, nitrik oksite dönüştürülür.
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g) (ΔH = -905.2 kJ)
Nitrik oksit daha sonra havada oksijen ile reaksiyona sokularak azot dioksit oluşturulur.
2NO(g) + O2(g) → 2NO2 (g) (ΔH = -114 kJ / mol)
Sonra asit dioksit suya konularak nitrik asit oluşturulur.
3NO2 (g) + H2O → 2HNO3(aq) + NO(g) (ΔH = -117 kJ / mol)
Elde edilen sulu HNO3, kütle itibariyle yaklaşık% 68'e kadar damıtmayla konsantre edilebilir. Konsantre H2SO4 ile dehidrasyonla % 98'e kadar daha fazla konsantrasyon elde edilebilir.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
