D Bloku Elementleri ve Özellikleri
Periyodik tabloda aynı gruptaki elementler benzer kimyasal özellikler gösterir. Bunun yanında yan yana yakın olan grupların da özellikleri birbirine yakındır. Periyodik tablo bu açıdan çeşitli bloklara ayrılmıştır. Bu yazıda d bloku elementleri ve özellikleri üzerinde duracağız.
d bloku elementleri 4. periyottan itibaren başlar. Soldan sağa doğru ilk sütun 3B grubudur. Daha sonra 4B, 5B, 6B, 7B, 8B, 8B, 8B, 1B, 2B şeklinde devam eder. Dikkat ederseniz üç adet 8B grubu bulunmaktadır. Böylece 8B'ye kadar grup olmasına rağmen 10 adet B grubu vardır.
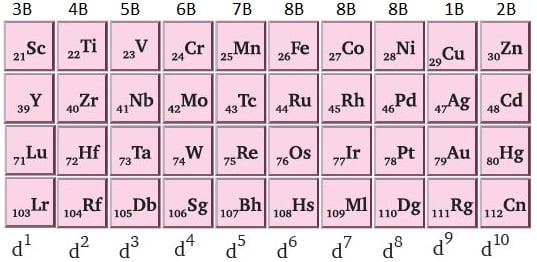
Geçiş elementlerinin özkütleleri çoğunlukla yüksektir. Bu elementlerin birçoğu ağır metal sınıfındadır.
d Bloku Elementlerinin Özellikleri
d bloku elementlerinin genel özellikleri maddeler halinde aşağıda sıralanmıştır:
- Periyodik tablonun B grubu elementleridir.
- Elektron dizilişleri d orbitaliyle biter.
- 2A ve 3A grupları arasında yer alır.
- 10 gruptan oluşur.
- 4. periyottan itibaren bulunur.
- En fazla element içeren bloktur.
- Geçiş metalleri veya geçiş elementleri olarak adlandırılırlar.
- Özkütlesi yüksek ağır metallerden oluşmuştur.
Bu genel özelliklerin yanında periyodik özellikler üzerinde de duralım.
1. Metal Karakter
Bu elementlerin tamamı metal karakterdedir. Geçiş metalleri olarak adlandırılan bu elementlerin çoğunlukla parlak ve gümüşsü bir görüntüye sahiptir. Metallerin genel özelliklerinde olduğu gibi erime ve kaynama noktaları yüksektir. Isı ve elektriği iyi iletirler.
d bloku elementlerinden bakır (Cu), altın (Au) ve gümüş (Ag) en iyi iletken maddeler arasında yer alır. d bloku elementlerinin birbirinden çok farklı özellikleri bulunur. Örneğin civa oda sıcaklığında sıvı haldeyken erime noktası binlerce derece olan metaller de bulunmaktadır.
Yine bazı metaller epey yumuşakken bazıları oldukça serttir. Altın, bakır ve gümüş gibi bazı metaller oldukça yumuşak iken çok sert metaller de bulunmaktadır.
2. İyon Yükü
d blokunda bulunan elementler genellikle farklı pozitif yükler alırlar. Kimyasal reaksiyona girecekleri zaman elektron diziliminin en sonunda yer alan s ve d orbitallerinde yer alan bazı elektronları verirler.
Geçiş metallerinde elektron dizilimi ns (n-1)d orbitalleri ile biter. d blokunda bulunan metaller, son katmandaki s orbitalinde bulunan elektronlar ile birlikte daha alt katmanda bulunan d orbitalindeki elektronları da verebilir. Bu metaller elektron verirken d orbitalinden önce dış katmanda bulunan s orbitalinden elektron verir.
d bloku elementleri bileşiklerinde çoğunlukla birbirinden farklı iyon yükleri alabilir. Örneğin Cu+, Cu+2; Hg+, Hg+2; Fe+2, Fe+3; Pb+2, Pb+4.
d blokunun ilk elementi 3B grubundaki skandiyum metali 21Sc: 1s2 2s2 2p6 3s2 3p6 4s2 3d1 elektron dizilişine sahiptir. Kimyasal reaksiyonlarda 4s orbitalinde bulunan 2 ve 3d orbitalinde bulunan 1 elektronu vererek +3 iyon yükü alabilir.
4. periyotta d blokunun son elementi olarak yer alan çinko 30Zn: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 elektron dizilişine sahiptir. Bu da bize d orbitalinin tam dolu olduğunu gösterir. Geçiş metallerinin büyük bir kısmı tam dolu olmayan d orbitalleri sebebiyle farklı iyon yüklerine sahip olabiliyorken Zn yalnızca +2 iyon yükünde bulunur. Çinko (Zn) ile aynı grupta bulunan cıva (Hg) da bileşiklerinde +1 ve +2 iyon yüklerini alır.
3. Aktiflikleri
d bloku elementleri farklı özellikler gösterdikleri gibi bu elementlerin aktiflikleri de değişkendir. Bu metallerinin kimyasal reaksiyonlara ilgisi aktifliklerine bağlı bir şekilde değişir.
d blokunda yer alan ve soy metal olan altın (Au) ve platin (Pt) elementleri aktif değillerdir. Bu nedenle hava, su, asit ve bazlarla tepkimeye girmezler. Tepkime vermedikleri için de kolay kolay bozulmazlar. Bu nedenle bu maddeler kıymetli metallerdir. Soy metaller sadece kral suyu ile tepkimeye girer.
Bakır (Cu), gümüş (Ag), cıva (Hg) elementleri ise yarı soy metaldir. Bu metallerin aktiflikleri epey düşüktür. Bu sebeple bu maddeler doğada serbest olarak bulunabilir. Yarı soy metaller oksijenler çok yavaş tepkimeye girer. Yani çok geç paslanırlar. Kuvvetli ve bol oksijenli asitlerle de tepkime verirler.
Demir ve titanyum gibi birçok geçiş metali ise oksijenle kolay tepkimeye girer ve oksitler oluşturur. Geçiş metallerinin büyük bir bölümü, asitlerdeki hidrojen iyonu (H+) ile yer değiştirir ve hidrojen gazı (H2) açığa çıkarır.
Metal olarak aktiflik aşağıya doğru genel olarak artma eğilimi gösterir. Ancak 1B grubunda yer alan çinko (Zn), kadmiyum (Cd) elementine göre daha aktiftir. Yani bu durumun istisnaları bulunmaktadır.
6B grubunun ilk elementi olan kromun (Cr) yüzeyinde oksit tabakası oluşur. Bu nedenle aktifliği olması gerekenden çok daha azdır. Yüzeyde oluşan oksit tabakası sayesinde su ve havadan etkilenmez. Toz krom ise gayet aktiftir.
7B grubunun ilk elementi olan mangan (Mn), kromdan daha aktiftir. Halbuki daha sağda yer alır. Geçiş metalleri içerisinde genel olarak sağa doğru metalik aktiflik azalsa dahi çeşitli istisnalar bulunmaktadır.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
