Zayıf Asit Nedir?
Asit ve bazlar kimyada çok önemli bir bileşik grubudur. Bir bileşiğin asitlik veya bazlığı bileşiğin temel özelliklerini de belirler. Bileşikler konusunda temel bileşik guruplarını anlatmıştık. Asitleri kuvvetli asitler ve zayıf asitler olarak sınıflandırabiliriz. Aynı şekilde bazları da kuvvetli bazlar ve zayıf bazlar olarak sınıflandırırız.
Bu yazıda zayıf asitler üzerinde duracağız.
Zayıf Asitler ve Özellikleri
Zayıf asitleri öğrenmeye zayıf asit nedir sorusunu sorarak başlayalım.
Zayıf Asidin Tanımı
Sulu çözeltilerinde tamamen iyonlaşan asit ve bazlara ise kuvvetli asit ya da kuvvetli baz denir. Bir asitin kuvvetli ya da zayıf olması çözünmesiyle değil, çözelti içerisinde iyonlaşmasıyla ölçülür. Bazı zayıf asitler çok iyi çözünür ama çok iyi iyonlaşmaz.
Zayıf asitin konjuge bazı zayıf baz, kuvvetli asitin konjuge bazı ise kuvvetli baz olur.
Anlaşılması için şöyle bir örnek verelim. İki asiti ayrı iki kaba döküp sulu çözelti yaparsak, kuvvetli asit daha fazla iyonlaşacaktır. Bu nedenle pH değeri de daha düşük olacaktır.
Zayıf Asit Örnekleri
Zayıf asitlerin doğada bulunma oranı kuvvetli asitlere göre daha fazladır. Sirke, limon suyu gibi maddeler zayıf aside örnek olarak gösterilebilir.
Bazı yaygın zayıf asit örnekleri aşağıdaki tabloda gösterilmiştir:
| Asit | Formülü |
|---|---|
| Asetik asit | CH3COOH |
| Formik asit | HCOOH |
| Hidrosiyanik asit | HCN |
| Hidroflorik asit | HF |
| Hidrojen sülfür | H2S |
| Trikloroasetik asit | CCl3COOH |
Ayrıca su hem zayıf asit hem de zayıf baz özelliği gösterir.
Zayıf Asitlerin İyonlaşması
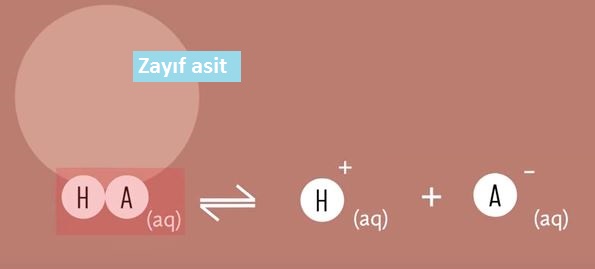
Tek yönlü gerçekleşen tepkimeler tek okla gösterilir. Ancak zayıf asitler iyi iyonlaşmadığı için genellikle denge tepkimeleri oluşturur. Bu nedenle bu asitlerin iyonlaşması çift yönlü ok ile gösterilir. Çift yönlü ok reaksiyonun hem ileri yönde hem de geri yönde gerçekleştiğini gösterir.
HA ⇌ H+ + A−
Yukarıda bir zatıf asidin iyonlaşması gösterilmiştir.
Asetik asitin kimyasal olarak iyonlaşmasını da şöyle gösterebiliriz:
H3COOH ⇌ CH3COO– + H+
Asitlerin iyonlaşırken H+ iyonu açığa çıkardığına dikkat ediniz.
Asitler Neden İyonlaşır?
Bir asidin suda tamamen iyonize olup olmadığı, elektronların kimyasal bağdaki polaritesi ya da dağılımına bağlıdır. Bir bağdaki iki atomun elektronegatiflik değerleri yakınsa elektron iki atom arasında eşit paylaşılır. (Apolar bağ)
Öte yandan, atomlar arasında önemli bir elektronegatiflik farkı olduğu zaman, elektronların bir atomdan diğerine kıyasla daha fazla çekildiği (polar bağ veya iyonik bağ) bir yük ayrımı vardır. Bir elektronegatif elemana bağlandığında hidrojen atomları hafif bir pozitif yüke sahiptir. Hidrojende daha az elektron yoğunluğu varsa, iyonlaşması daha kolay hale gelir ve molekül daha asidik hale gelir. Hidrojen iyonunun kolayca çıkarılabilmesi için bağdaki hidrojen atomu ve diğer atom arasında yeterli polarite olmadığında zayıf asit oluşur.
Bir asidin mukavemetini etkileyen bir diğer faktör, hidrojene bağlanan atomun büyüklüğüdür. Atomun büyüklüğü arttıkça iki atom arasındaki bağın gücü azalır. Bu, hidrojeni serbest bırakmak için bağın kırılmasını kolaylaştırır ve asit kuvvetini arttırır.
Etiketler:
Son Eklenenler
- Tarımla İlgili Meslekler
- Matematiği İyi Olmayanlar Hangi Mesleği Seçmeli?
- Antropoloji Nedir?
- Dünyanın Kaç Türlü Hareketi Vardır?
- Toplumsal Düzeni Sağlayan Kurallar Nelerdir?
- Cumhuriyet Yönetiminin Değerleri Nelerdir?
- İklim ve Hava Olayları Arasındaki Fark
- 1 Asal Sayı Mıdır?
- Homeostasi nedir?
- 2 ile Bölünebilme Kuralı
