Kimyasal Denge
Kimya içerisindeki en önemli konulardan biri kimyasal denge konusudur. Kimyasal denge tepkimelerin çift yönlü statik bir hal almasında ortaya çıkar.
Kimyasal Denge ve Dengeyi Belirleyen Faktörler
Bir kimyasal denge birçok olaydan etkilenir. Dengeyi belirleyen ve etkileyen olaylar anlaşıldığında kimyasal denge konusu daha iyi anlaşılmış olur.
Bir tepkimenin denge tepkimesi olarak işlem görmesi için tersinir tepkime olması gerekir.
A(g) + B(g) ⇔ C(g) + D(g)
Bu yazılış şekli bir tersinir tepkimeyi ifade etmektedir. A ile B birleşerek C ve D maddelerini oluşturduğu andan itibaren C ile D birleşerek A ve B maddelerini oluşturur. Başlangıçta A ile B’nin birleşerek C ve D maddelerini oluşturma hızı yüksek, C ile D’nin birleşerek A ve B maddelerini oluşturma hızı ise düşüktür. Zamanla ileri yöndeki tepkimenin hızı azalırken, geri yöndeki tepkimenin hızı artar. Belli bir süre sonra iki yöndeki tepkime hızları eşit olur.
Bu tepkimelerde hem tepkimeye girenler hem de ürünler, ölçülecek oranda mevcut olurlar. Bu tepkime dengeye varınca, ortamda her dört maddeden belli miktarda bulunur. Sıcaklık aynı olmak koşuluyla bu dört madde hangi oranda karıştırılırsa karıştırılsın tepkime sonunda her maddeden belli oranda içeren bir sistem elde edilir.
Bir fiziksel veya kimyasal olayın dengeye ulaşabilmesi için:
a) Sistem kapalı olmalıdır.
Sisteme maddelerin giriş ve çıkışının olmaması gerekir. Bir sistemde giren veya çıkan gaz maddeler varsa, sistem açık olduğu takdirde tepkime tek yönlü devam eder ve tersinir olmadığı için denge oluşmaz.
X(k) + 2H+(aq) → X+2(aq) + H2(g)
tepkimesi açık bir kapta gerçekleşiyorsa oluşan H2 gazı ortamı terk eder. Tepkime tersinir olmadığı için dengeye ulaşamaz.
b) Sistemin sıcaklığı sabit olmalıdır.
Sistemin sıcaklığının değişmesi halinde tepkime tek yönlü olarak devam eder. Tersinir olmadığı için denge oluşmaz.
Genellikle, mutlak değer olarak çok büyük ΔH değerlerine sahip tepkimeler normal koşullarda, tek yönlüdür. Tersinmez tepkimelerdir. Bu tepkimelerde denge oluşmaz.
Enerji alış verişi küçük olan tepkimeler ise normal koşullarda, tersinir tepkimelerdir. Bu tepkimelerde denge oluşur. Bunun için sistemin sıcaklığının sabit tutulması gerekir.
Bir olayda denge;
1. Minimum enerji ile maksimum düzensizlik arasındaki uzlaşmadır. Bir olayda minimum enerjili olma eğilimi olayı bir yöne çekerken, maksimum düzensizlik eğilimi ise olayı diğer tarafa çeker. Bu iki eğilim, sistemi kendi lehine değiştirmek ister.
Minimum enerjili olma eğilimi; sistemin daha düşük enerjili hale geçme, enerjisini cebirsel anlamda düşürme eğilimdedir. Tepkimeyi sağa (ürünler tarafına) çeker.
Maksimum düzensizliğe doğru eğilim ise, sistemin düzenli halden daha düzensiz hale kendiliğinden geçme eğilimi göstermesidir. Bu tepkimede maksimum düzensizlik eğilimi tepkimeyi sola (girenler tarafına) çeker.
Maksimum düzensizlik eğilimi olayı sola çeker. Minimum enerjili olma eğilimi ise olayı sağa çeker.
Minimum enerjili olma eğilimi tepkimeyi sola çeker. Maksimum düzensiz olma eğilimi tepkimeyi sağa çeker.
Bir tepkimenin dengeye ulaşması için minimum enerjili olma eğilimi ile maksimum düzensiz olma eğilimi arasında uzlaşma olmalıdır.
2. Gözlenebilir olayların durduğu fakat mikroskobik olayların halen devam ettiği dinamik bir olaydır. Sıvı - buhar dengesinde bir yanda gaz fazındaki moleküller sıvı faza geçerken diğer yandan sıvı fazındaki moleküller gaz faza geçer. Ancak bu değişim makro düzeyde gözlenemez. Sıvının hacmi ve gaz fazının yoğunluğu değişmez. Bundan da anlaşıldığı gibi gözlenebilen olayların bittiği gözlenemeyen (mikro) olayların devam ettiği dinamik bir olaydır.
3. İleri tepkime hızının geri tepkime hızına eşit olmasıdır. Bu madde daha sonraki bölümde açıklanacaktır.
Dengenin Sınıflandırılması
Fiziksel Denge
Maddenin fiziksel hallerinin değişimleri sırasında, maddelerin halleri arasındaki dengeye denir.
Kapalı bir kapta ve sabit sıcaklıkta bulunan bir sıvının buhar hali ile sıvı hali arasında denge oluşur. Bu sıvının su olduğu düşünülürse, 1. ve 2. yöndeki hızlar eşit olur.
Belli bir zamanda buharlaşan sıvı molekül sayısı ile aynı zamanda yoğunlaşan gaz (buhar) molekül sayısı eşit olur.
Sabit sıcaklıkta kapalı bir kapta bulunan buz ile su arasında denge oluşur. Katı fazdan sıvı faza geçen molekül sayısı ile sıvı fazdan katı faza geçen molekül sayısı eşit olur.
1. ve 2. yöndeki hızları eşit olur.
Suda az çözünen bir katının doymuş ve dibinde katısı bulunan çözeltisinde katı faz ile çözelti arasında denge oluşur. AgCI suda az çözünen bir tuzdur.
Kimyasal Denge
Denge; maddelerin kimyasal etkileşimleri sonucunda oluşuyorsa bu kimyasal dengedir. Kimyasal dengenin oluşabilmesi için tepkimenin tersinir olması gerekir.
H2(g) + I2(g) ⇔2HI(g) tepkimesinde oluşacak bir denge, kimyasal dengedir. Kimyasal denge ikiye ayrılır.
Homojen Denge
Bir kimyasal denge tepkimesinde tepkimeye girenlerle tepkimeden çıkanlar aynı fiziksel fazda bulunuyorsa, böyle dengelere homojen denge denir.
Heterojen Denge
İki veya daha çok fazlı dengelere, heterojen denge denir.
Kimyasal Denge Bağıntısı ve Denge Sabiti
aA(g) + bB(g) ⇔ cC(g) + dD(g)
tepkimesinde ilk başta 1 yönündeki tepkimenin hızı maksimum 2 yönündeki tepkimenin hızı minimumdur. Zaman içerisinde 1 yönündeki hız azalırken 2 yönündeki hız artar ve belli bir yerde eşitlenirler.
Bu aşamada sistemin gözlenebilir özellikleri olan renk, basınç, iletkenlik, hacim vb. sabit kalır değişmez. Bu özelliklerin değişmemesi tepkimenin dengede olduğunu belirtir. Bunun doğru olabilmesi için sistemin kapalı, sıcaklığın sabit olması gerekir.
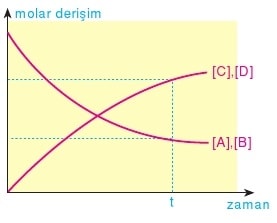
Tepkime t anında dengeye ulaşmıştır. Bu aşamadan sonra tepkimedeki maddelerin derişimleri değişmez. İleri ve geri tepkime hızları eşit olur.
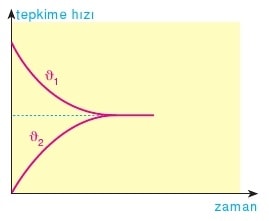
ϑ1 = TH1 = k1[A]a[B]b
ϑ2 = TH2 = k2[C]c[D]d
Tepkimelerin denge anınad hızları eşit olur. Yani TH1 = TH2 olur.
k1[A]a[B]b = k2[C]c[D]d
Bu denklikten yeni bir denge bağıntısı elde edilebilir. Derişimlere bağlı denge sabitine Kc dersek.
Kc = k1/k2 = [C]c[D] d/ [A]a[B]b
Yukarıda yazılan bağıntı, tepkimenin denge sabiti bağıntısı ve Kc ise tepkimenin denge sabitidir.
Denge bağıntısı yazılırken saf katı ve sıvıların derişimleri sabit olduğundan denge bağıntısında gösterilmezler. Denge bağıntısına gazlar ve çözeltiler yazılır.
Her tepkimenin sıcaklığa bağlı bir denge sabiti vardır.
Deneyler, her tepkimenin denge derişimleri arasında o tepkimeye özgü bir bağıntı olduğunu göstermiştir. Her tepkime için tipik olan denge sabiti ise sıcaklık değiştikçe değişen bir orandır.
Kc = [Ürünler] / [Girenler]
Denge sabiti; ürünlerin derişimleri çarpımının (katsayılar üs olarak kullanılacak) girenlerin derişimleri çarpımına (katsayılar üs olarak kullanılacak) bölümü ile bulunur.
Gaz tepkimeleri için denge sabitleri hem molar derişimler hem de kısmi basınçlar kullanılarak yazılabilir.
İdeal gaz denklemi (P.v = n.R.T) kullanıldığında kısmi basınçlar cinsinden denge sabiti ile derişimler cinsinden denge sabiti arasındaki bağıntı buluanbilir.
Kp = Kc.(RT)Δn şeklinde olur.
Burada Δn ürünler ile girenlerin mol sayısı farkıdır. Ürünler ve girenlerin mol sayısı eşitse Δn 0 olur. Bu durumda formülden de anlaşıldığı gibi Kp = Kc olur.
Mekanizmalı tepkimelerde denge bağıntısı toplam tepkimeye göre yazılır. Buna göre;
Kc büyük ise ileri tepkimenin hız sabiti, geri tepkimenin hız sabitinden büyüktür. Denge ürünler lehinedir.
Endotermik tepkimelerde sıcaklık arttığında denge sabitinin sayısal değeri büyür.
Ekzotermik tepkimelerde sıcaklık artırıldığında denge sabitinin sayısal değeri küçülür.
Derişim değiştirme, basınç değiştirme ve katalizör kullanma denge sabitlerini değiştirmez. Denge sabitleri sadece sıcaklıkla değişir.
1. Derişim Türünden Denge Sabiti
Bir tepkimede ürünlerin ve girenlerin derişimleri verilirse, denge bağıntısından denge sabiti hesaplanabilir. Denge sabitinin belli bir birimi yoktur. Dengedeki maddelerin katsayılarının durumuna göre değişik birimlerde gerçekleşebilir.
Azalma ve artma; tek basamak olarak “değişim” adı altında kullanılabilir.
2. Basınç Türünden Denge
Gazlar arasında yürüyen tepkimelerde, gazların dengedeki kısmi basınçları verilirse denge bağıntısından Kp hesaplanabilir. Dengedeki maddelerin mol sayıları ve toplam basıncın bilinmesi halinde kısmi basınç bağıntısı kullanılarak maddelerin kısmi basınçları da hesaplanabilir.
3. Bir Tepkimenin Denge Durumu
Herhangi bir anda, kapalı bir sistemde bir tepkimenin dengede olup olmadığını veya hangi yönde ilerlediğini denge kesri kavramı ile açıklayabiliriz.
