Maddenin Tanımı ve Özellikleri
Kimya: Maddenin özelliklerini, iç yapısını, reaksiyonlarını ve meydana gelen enerji değişimini inceleyen bilimdir.
Kütlesi, hacmi ve eylemsizliği olan her şeye madde denir. Maddenin uzayda kapladığı yere hacim, bu hacmi dolduran madde miktarına kütle denir. Kütlenin birimi kg ve katları, hacmin birimi cm3 ve katlarıdır. Eylemsizlik ise durgun bir cismin durmak istemesi, hareketli olan bir cismin de hareket etme eğiliminde olmasıdır. Eylemsizliğin birimi yoktur. Maddenin katı, sıvı ve gaz olmak üzere üç hali vardır.
Maddenin Fiziksel Halleri
Madde tabiatta üç halde bulunur. Bunlar katı, sıvı ve gazdır. (Bazı bilim adamları maddenin plazma adı verilen dördüncü bir hali olduğunu kabul etmektedir. Maddenin bu halinin öz kütlesi çok yüksek olup yıldızlarda var olduğu bilinmektedir. Ayrıcı likit kristal halin maddenin beşinci hali olduğu bilim adamları tarafından kabul edilmiştir.)
Bir madde sıcaklık ve basınca bağlı olarak üç halde bulunabilir. Maddenin hal değişimlerine ilişkin terimler aşağıdaki şekilde gösterilmiştir.
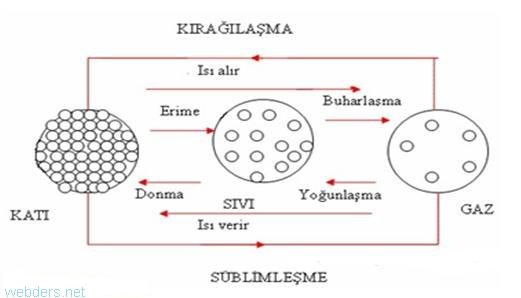
Maddelerin Sınıflandırılması
Maddelerin sınıflandırılması önemlidir.
Saf (Arı) Madde
Aynı cins atom veya moleküllerden oluşmuş maddelerdir. Saf maddelerin; sabit basınç ve sıcaklıkta kendisine özgü, yoğunluğu, erime noktası, kaynama noktası ve çözünürlüğü vardır.
Element
Aynı cins atomlardan oluşan saf maddelere element denir. Elementler tabiatta atomik ya da moleküler halde bulunurlar. He, Na, O2, O3 ve N elementlere örnektir.
Elementlerin Özellikleri
- Saf (arı) maddelerdir.
- Yoğunlukları sabittir.
- Elementler semboller ile gösterilir.
- Sabit erime ve kaynama noktaları vardır.
- Kimyasal yollar ile daha basit maddelere dönüştürülemezler.
- Homojendirler.
Elementleri metaleller, ametaller ve soygazlar olarak gruplayabiliriz.
| Özellikler/elementler | Metaller | Ametaller | Soygazlar |
| Elektrik ve ısıyı | İletir | İletmez | İletmez |
| Yüzeyleri | Parlaktır | Mattır | - |
| Tel ve levha haline | Getirilebilir | Getirilemez | Getirilemez |
| Örnek | Demir, Altın | Karbon, Klor | Helyum, Argon |
| Bileşikteki değerlik | Pozitif | Pozitif ve negatif | Yok |
Bileşik
İki ya da daha fazla maddenin kimyasal özelliklerini kaybederek sabit kütle oranlarında bir araya gelmesiyle oluşturulan yeni saf maddeye bileşik denir. Bileşiğin en küçük birimi farklı atomlardan oluşan moleküller veya iyonlardır. CO2, NH3, H2O molekül yapılı bileşiklere, NaCl, Al2(SO4)3 ise iyonik bağlı bileşiklere örnektir.
Bileşiklerin Özellikleri
- Saf maddelerdir.
- Homojendirler.
- Yoğunlukları sabittir.
- Erime ve kaynama noktaları sabittir.
- Formüller ile gösterilirler.
- Bileşenleri arasında sabit kütle oranı vardır.
- Bileşenlerinin kimyasal özelliğini göstermezler.
- Kimyasal yollar ile ayrışırlar.
Örnek:
I. Demir (Fe)
II. Saf su (H2O)
III. Tuzlu su (NaCl - H2O)
IV. Oksijen gazı (O2)
Yukarıdakilerden hangileri elementtir?
Çözüm
Aynı cins atomalardan meydana gelen Fe ve O2 elementtir. Su bileşik, tuzlu su ise karışımdır.
Karışım
Birden fazla maddenin kimyasal özelliklerini kaybetmeden rastgele kütle oranlarında bir araya gelmesiyle oluşan maddelerdir. Karışımlar homojen ve heterojen olarak ikiye ayrılır.
Homojen Karışım
Özellikleri her yerinde aynı olan karışımlardır. Etil alkol - su, alaşımlar, gaz karışımları gibi.
Tüm arı maddeler homojendir. Ancak tüm homojen maddeler arı madde değildir. Homojen bir madde, arı madde (element ya da bileşik) olabildiği gibi karışım da olabilir.
Heterojen Karışım
Özellikleri her yerinde aynı olmayan karışımlardır. Zeytinyağı - su, süt, ayran, su - kum gibi. Bazı heterojen karışımların özel isimleri vardır.
Emülsiyon: Bir sıvıda başka bir sıvının damlacıklar halinde heterojen dağılmasıdır. Örneğim zeytinyağı - su karşımı.
Süspansiyon: Bir sıvıda başka bir katının parçacıklar halinde heterojen dağılmasıdır. Örneğin tebeşir tozu - su karışımı.
Aerosol: Bir gaz içerisinde sıvı damlacıklarom veya karı parçacıkların heterojen dağılmasıdır. Örneğin sis.
Karışımın Genel Özellikleri
- Saf değildirler.
- Fiziksel yollar ile bileşenlerine ayrışır.
- Yoğunlukları sabit değildir.
- Erime noktası sabit değildir.
- Karışımda farklı cins atom veya moleküller bulunur.
- Bileşenleri kimyasal özelliklerini kaybetmezler.
- Homojen veya heterojen olabilirler.
Kolloidal Karışımlar
Bazı heterojen karışımlarda bir madde, başka bir maddenin içinde ince taneli olarak dağılmıştır. Bunlara kolloidal karışımlar denir. Dağılmanın gerçekleştiği ortamın ve dağılan maddenin fiziksel haline göre çeşitli türleri vardır. Kolloidal karışımlarda, dağılmış taneciklerin çapları, çözeltilerde çözünmüş taneciklerinki kadar küçük değildir.
Not: Maddenin yapısındaki faz kavramı ile maddenin fiziksel hali birbirine karıştırılmamalıdır. Bu kavramlar her zaman ayrı anlamda kullanılmaz. Gaz hali ile gaz fazı aynı anlamı verebildiği halde sıvı ve katılarda aynı fiziksel halde iki farklı faz bulunabilir. Zeytinyağı ile su karşımı sıvı halde bir maddedir. Ancak üstte zeytinyağı, altta su olmak üzere iki ayrı faz içerir.
Örnek:
I. Lehim
II. Şekerli su
III. Toprak
Maddelerinden hangileri homojen karışımdır?
Çözüm
Lehim ve şekerli su karışımları, karışımın her tarafında aynı özelliği gösterirler. Bu yüzden homojen karışımdırlar.
Elementler, Bileşikler ve Karışımlar Arasındaki Farklar
| Özellikler/maddeler | Bileşik | Karışım | Element |
| Bileşenleri arasındaki oran | Sabittir | Değişkendir | Yoktur |
| Bileşenleri, kendi özelliklerini | Kaybeder | Korur | Yoktur |
| Bileşenlerine ayrılma yöntemi | Kimyasal | Fiziksel | Yoktur |
| Erime ve kaynama noktaları | Sabittir | Değişkendir | Sabittir |
| Yoğunlukları | Sabittir | Değişkendir/td> | Sabittir |
| Gösterilme durumu | Formüllerle | Yoktur | Sembollerle |
Maddenin Fiziksel ve Kimyasal Özellikleri
Maddenin özelliklerini fiziksel ve kimyasal özellikelr diye ikiye ayırabiliriz.
Maddenin Fiziksel Özellikleri ve Fiziksel Olay
Maddenin ölçülebilen, gözlenebilen, dış görünüşü ile ilgili olan özelliklere fiziksel özellik denir. Renk, koku, tat, sertlik, yoğunluk, ısı iletkenliği, elektrik iletkenliği, erime noktası, kaynama noktası, çözünürlük gibi özellikler fiziksel özelliklerdir.
Maddenin kimyasal yapısının bozulmadığı değişimlerde fiziksel değişim denir.
- NaCl tuzunun suda çözünmesi NaCl(k) → Na+(aq) + Cl-(aq)
- Naftalinin süblimleşmesi
- Suyun donması
- Kağıdın yırtılması
- Mumun ısıtılarak eritilmesi
- Bakır telin elektriği iletmesi
Fiziksel değişmelere örnektir.
Maddenin Kimyasal Özellikleri ve Kimyasal Olay
Maddenin tanecikleri (atom ve molekülleri) ile ilgili olan özelliklere kimyasal özellik denir. Örneğin bir maddenin asit veya bazla reaksiyon verip vermemesi, yanıcı olup olmaması gibi özellikleri o maddenin kimyasal özellikleridir. Kimyasal olay ise; maddenin atom veya moleküllerinde meydana gelen değişimlerdir.
- Suyun elektrolizi (H2O → H2 + 1/2O2)
- Yumurtanın pişmesi
- Zn nin HCl de çözünmesi
- Kömürün yanması
Kimyasal değişmelere örnektir.
Not: Kimyasal olay gerçekleştiğinde fiziksel değişim de meydana gelir. Ancak fiziksel değişim olduğunda kimyasal değişim meydana gelmez.
Örnek:
I. CO2 gazının kireç suyunu bulandırması
II. Yağlı boyanın kuruması
III. Gökkuşağının oluşması
Olaylarından hangileri kimyasal olaydır?
Çözüm
CO2 kireç suyunda Ca(OH)2 + CO2 → CaCO3 + H2O tepkimesini verir. Yağlı boya havadaki oksijenle tepkime verir. Gökkuşağının oluşması ise fizikseldir.
Maddenin Ortak ve Ayırt Edici Özellikleri
Maddenin özelliklerini ortak ve ayırt edici özellikler olarak ayırabiliriz.
Maddenin Ortak Özellikleri
- Kütle
- Hacim
- Eylemsizlik
Maddenin Ayırt Edici Özellikleri
Maddenin ayırt edici özellikleri miktarına, şekline bağlı olmayıp, maddenin cinsine bağlıdır.
- Özkütle (yoğunluk)
- Erime ve kaynama noktası
- Çözünürlük
- Esneklik
- Isı ile genleşme
- Öz ısı
- Elektrik iletkenliği
Yoğunluk (özkütle)
Birim hacimdeki madde miktarına denir. Yoğunluk kütlenin hacme bölünmesiyle elde edilir. Bir maddenin yoğunluğu o maddenin en temel özelliklerinden biridir. Yoğunluk ya da özkütle özellikle saf maddeler için ayırt edici bir özelliktir.
Yoğunluk (d) = Kütle (m) / Hacim (V) formülü kullanılır. Kütle hacim grafiğinin eğimi yoğunluğu verir.
Genellikle bütün maddelerin yoğunluğu en yüksek katı halde, en düşük ise gaz halinde karşımıza çıkar.
Erime ve Kaynama Noktası
Erime ve kaynama noktası saf maddeler için ayırt edici bir özelliktir. Erime ve kaynama noktasını ifade ederken belirli koşullar için ifade ederiz. Örneğin deniz seviyesinde ifadesi basıncı ifade eder. Farklı basınçlarda erime ve kaynama noktası da değişir.
Isınma ve soğuma grafikleri, bir maddeye verilen veya maddenin verdiği ısı miktarına bağlı olarak sıcaklığın değişimini gösterir. Maddeler ısındıkça sıcaklıkları artar. Ancak hal değiştirme sırasında sıcaklık sabittir. Bu durum saf maddeler için böyledir. Ancak karışımlarda hal değiştirme sırasında da sıcaklık sabit değildir.
Çözünürlük
Belirli sıcaklık ve basınçta 100 gram çözücüde çözünebilen maksimum madde miktarına çözünürlük denir.
Çözünürlük, çözünen ve çözücünün cinsine, sıcaklığa ve ortak iyon derişime bağlıdır. Gazların sıvı içerisinde çözünmesinde basınç da etkilidir. Değişik maddelerin aynı koşullarda belli bir çözücüdeki çözünürlükleri ayırt edici özelliktir.
Esneklik
Katıların üzerine bir kuvvet uygulandığında üzerindeki değişime esneklik denir. Sadece katılar için ayırt edici bir özelliktir.
Genleşme
Bir maddenin sıcaklığının yükseltilmesi sonucunda hacminin artmasına genleşme denir. Genleşmenin nedeni sıcaklık artışıdır. Sıcaklığın artması moleküllerin kinetik enerjisinin artması demektir. Kinetik enerji arttıkça moleküller daha çok hareket edecek ve hacimsel büyümeye neden olacaktır.
Bütün gazların genleşme katsayısı aynıdır. Bu nedenle genleşme sadece katı ve sıvılar için ayırt edici özelliktir.
Öz Isı
Bir maddenin 1 gramının sıcaklığını 1 °C arttırmak için gereken ısıya öz ısı denir. Bir maddenin farklı fazdaki öz ısısı da farklıdır. Öz ısı maddenin üç hali için de ayırt edicidir.
Elektrik İletkenliği
Maddelerin üzerinden akım elektrik akımını aktarma özelliklerine elektrik iletkenliği denir. İletkenliği etkileyen faktör dirençtir. Direncin artması akımın geçmesini zorlaştırır. Farklı maddelerin farkı dirençleri vardır. Bu nedenle elektrik iletkenliği ayırt edici bir özelliktir.
