Mol Kavramı
Kimya biliminin alfabesi sayılabilecek konu mol kavramı konusudur. Mol kavramının iyi anlaşılması için önce bağıl atom kütlesi incelenmelidir. Ardından mol kavramıyla ilgili anlatılan diğer bilgilerin de sonuna kadar okunması ve not alınması önemlidir.
Bağıl Atom Kütlesi
Atomlar gözle görülemeyecek kadar küçük tanecikler olduğu için standart kütle birimleri kullanmak değer açısından çok büyük sonuçlar ortaya çıkaracağından yeni bir kütle birimi geliştirilmiştir.
1961 yılında IUPAC (Uluslararası Uygulamalı ve Teorik Kimya Birliği) 12C atomunun kütlesini yaklaşık 12.000 olarak alıp 1/12'sini 1 tane atomun kütlesi olarak belirtmiştir. Gerçek atom kütlesi olarak kabul edilen bu değere atomik kütle birimi denmiştir.
Diğer elementlerin kütleleri ise 12C esas alınarak karşılaştırılmış ve bulunan değerlere bağıl atom kütlesi denmiştir. Bağıl atom kütlesine atom kütlesi denilebilir.
1 tane 12C atomunun kütlesinin 1/12'sine 1 atomik kütle birimi (akb) denir. Akb mol kavramı için çok önemli bir ölçümdür.
İzotop Atomlar ve Ortalama Atom Kütlesi
Bir atomun farklı nötron sayıları ile oluşan atomlarına izotop atom denir. Doğada bulunan izotoplar için ortalama bir atom kütlesi belirlenmesi gereklidir. Bu da farklı atom ağırlıklarının doğada bulunma yüzdeleriyle çarpılmasıyla hesaplanır.
Örneğin bir atomun doğada görülen kütle numaraları %20 oranda 35, %80 oranında 36 olsun. Bu durumda ortalama atom kütlesi (20.35 + 80.36)/100 = 35,8 bulunur.
Mol Kavramı Nedir?
Madde, atom ve moleküllerin sayılamayacak küçüklükte miktarlarından oluştuğuna göre, bu taneciklerin miktarını belirlemek için oluşturulan birime ''mol" denir.
Herhangi bir elementin miktarı artırıldığında diğer elementlerle olan oranı sabit kalır. Bu durumda her elementin bağıl atom kütlesi kadar miktarında eşit sayıda atom bulunur. Bu miktarı 1 atom - gram miktarı denir. 1 atom - gram elementteki atom sayısı 6,02.1023 tanedir. Bu sayıyı İtalyan bilim adamı Amedeo Avogadro adına atfen Avogadro sayısı denilmiştir.
Mol kavramı avagadro sayısı kadar tanecik için kullanılır.
1 mol tanecik = 6,02.1023 tane tanecik = NA
- 1 mol - molekül = 6,02x1023 tane molekül
- 1 mol - atom = 6,02x1023 tane atom
- 1 mol NH3 molekülü 6,02x1023 tane NH3 molekülü
- 1 mol Ca atomu 6,02x1023 tane Ca atomudur.
Atom - Molekül Kütlesi
Bir elementin 1 mol (6,02.1023 tane) atomunun gram olarak kütlesine atom kütlesi denir. Örneğin 1mol Ca 40 gramdır.
1 mol molekülün gram olarak kütlesine o bileşiğin molekül kütlesi denir. Bir bileşikteki elementlerin bağıl atom kütlelerinden yararlanılarak molekül kütlesi hesaplanır. Örneğin N: 14 ve O 16 olmak üzere N2O5 bileşiğinin molekül kütlesi:
N2O5 → 2N + 5O = 2.14 + 5.16 = 108 g N2O5 bileşiğinin molekül kütlesi 108g/mol dür.
1 mol tanecik kütlesi: Atom ya da molekül kütlesi (MA) gramdır.
- Elementlerde, Atom - gram
- Moleküllerde, Molekül - gram
- İyonlarda, İyon - gram
- Bileşiklerde, formül - gram
Bütün bu kavramlar yerine mol kavramı aynen kullanılabilir.
- 3 mol Mg atomu = 3 atom - gram Mg
- 1 mol CH4 molekülü = 2 molekül - gram CH4
- 1 mol S04-2 iyonu = 2 iyon - gram S04-2
- 1 mol BeF2 bileşiği = 2 formül - gram BeF2
- 2 mol O2 molekülü = 3 molekül - gram O2
Atomik Kütle Birimi (akb)
1 tane 12C kütlesinin 1/12'sine 1 akb denir.
1 tane taneciğin kütlesi MA.akb'dir.
1 tane taneciğin gram cinsinden kütlesi MA/NA ile bulunur.
(MA: Molekül kütlesi, NA: Avogadro sayısı)
Buna göre, 40Ca atomu için aşağıdaki yargılara ulaşılabilir.
6,02.1023 tane Ca atomu 40 gramdır.
1 tane Ca atomu 40 akb dir.
1 atom - g Ca 40 gramdır.
1 tane Ca atomu 40/avagadro sayısı gramdır. Bu değere Ca nın gerçek atom kütlesi denir.
Kimyasal Denklemlerin Denkleştirilmesi
Kimyasal denklemlerin denkleştirilmesi mol kavramı içerisinde önemli bir konudur. Eğer kimyasal denklemler konusunda gördüğünüz reaksiyonları mol kavramı ile sorulan sorular üzerinden hesaplarız.
Bir kimyasal tepkimede reaksiyona giren ve ürünlerde bulunan atomların sayılarının ve cinslerinin korunuyor olması gerekir. Bundan dolayı her iki taraftaki atom sayılarını eşitlemek için uygun katsayılar ile çarpılır.
Denklemde hidrojen (H) ve oksijen (O) varsa bunların eşitlenmesi en sona bırakılır.
C3H8 + O2 → CO2 + H2O
C3H8 in katsayısı 1 alınırsa 3 tane C olduğu için CO2'nin katsayısını 3 ile çarpılır. Böylece karbon sayıları eşitlenir. Girenlerde 8 tane H olduğu için H2O nun katsayısı 4 le çarpılıp H lar eşitlenir.
Son olarak O2'ye bakılır. Ürünlerde 10 tane (O) olduğuna göre, girenlerdeki O2'nin katsayısı 5 olur.
1C3H8 + 5O2 → 3CO2 + 4H2O
Bir kimyasal tepkimede:
Normal Şartlar altında; 0°C ve 1 atm basınçta 1 mol gaz 22,4 litredir.
Oda koşullarında; 25 °C ve 1 atm basınçta 1 mol gaz 24,5 litredir.
Aynı koşullar; Aynı sıcaklık ve basınç şartlarıdır. Böyle durumlarda mol sayısı hacimle doğru orantılıdır.1 mol, 1 litre alınabilir.
Avogadro hipotezi: Aynı koşullarda bulunan gazların eşit hacimlerinde eşit molekül vardır. Aynı koşullarda bulunan gazların kütleleri oranı molekül kütleleri oranına ve yoğunlukları oranına eşittir.
Mol Kavramı ile Kimyasal Hesaplamalar
Mol kavramı bilgisi baz alınarak birçok kimyasal hesaplama sorusu sorulabilir. Bu hesaplamaları nasıl yapacağımızı soru tipleri üzerinden görelim.
Denklemli Miktar Geçiş Problemleri
Denklemli miktar geçiş problemlerinde miktar geçişlerini yapabilmek için verilen denklemin mutlaka denkleştirilmesi gerekir. Denklemden yola çıkarak problem çözümünde katsayıların yorumu çok önemlidir. Mol sayısı sorularında olduğu gibi aynı mantıkla orantı kurulur, denklem katsayıları ile soru çözülür.
Örneğin; CO + 1/2O2 → CO2 tepkimesinde 8 gram O2 kullanılmışsa normal koşullarda kaç litre CO2 gazı ortaya çıkar.
Dikkat ederseniz soruda gram cinsinden bilgi verilmiş ve litre cinsinden değer sorulmuştur. Bu tür sorularda çözüme gitmek için tanecik sayısı ölçütü olan mol kavramını kullanmalıyız.
O2'nin atom ağırlığı 2.16 = 32 akb olur. 8 gram oksijen verildiğine göre 8/32 = 0,25 mol oksijen vardır. Mol sayısının katsayılar ile orantılı olduğunu belirtmiştik. Öyleyse CO2'nin mol sayısı oksijenin mol sayısının iki katı olmalıdır. Yani 2.0,25 = 0,50 mol bulunur.
Normal koşullarda bir mol gazın 22,4 litre olduğunu biliyoruz. Öyleyse 0,50 mol karbondioksit 11,2 litreye denk gelir.
Artık Madde Problemleri
Artık madde problemlerinde reaksiyon denkleşmemişse öncelikle denkleştirilir, reaktiflerden en az ikisinin miktarları bu tip sorularda belirtilir.
Reaksiyona giren maddelerden herhangi biri bittiğinde (tam verimli tepkime), diğer maddeden ne kadar fazla olursa olsun reaksiyon devam etmez. Çünkü maddelerden biri tükendiği için ürüne dönemez.
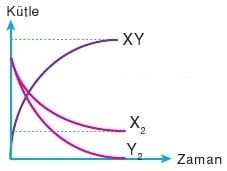
X2 + Y2 → 2XY reaksiyonu yukarıdaki grafiğe göre gerçekleştiğinde Y2’nin bittiğini X2 arttığını görürüz.
Tepkime için verilen miktarlar öncelikle mole çevrilir. Denklem katsayılarıyla hangi maddenin artacağı, hangi maddenin yetersiz kalacağı tespit edilir.
Oluşan maddelerin miktarları ise girenlerden miktarı sınırlı olana göre hesaplanır. Gaz fazındaki reaksiyonlarda mole çevirmeye gerek yoktur. Hacim oranları kanununa göre katsayılar birbirleriyle orantılı olduğu için soru hacim miktarlarına göre çözülür.
Karışım Problemleri
Bu tip problemlerde, gaz karışımları veya bir alaşım içerisinde bulunan herhangi bir bileşenin miktarının hesaplanması istenir.
Kimyasal reaksiyonlar yardımıyla karışımda bulunan herhangi bir bileşenin verdiği reaksiyon sonucu miktarı bulunur. Dolayısıyla diğer bileşenler toplam karışımdan çıkarılarak hesaplanır.
Örneğin; He, CH4 karışımında oksijen ile CH4 reaksiyona girer He soygaz olduğu için tepkime vermez. Tepkime sonunda açığa çıkan ürünlerden karışımdaki CH4 miktarına ulaşılır.
Bileşik Formülü Bulma Problemleri
Bir bileşiğin molekül formülünü bulmak için, o bileşiği oluşturan elementlerin; atom sayıları ya da kütleleri ve kütlece yüzde bileşimlerinin bilinmesi gerekir.
Bir bileşiğin kaba ve molekül formülü olmak üzere 2 türlü formülü vardır. Kaba formülden molekül formülüne ulaşmak için molekül kütlesinin bilinmesi gerekir.
Saf Madde Problemleri
Bir kimyasal reaksiyonda kullanılan maddeler saf olmayabilir. Bu tür problemlerde maddenin saf kısmı tepkimeye girecektir. Bu mantıkla mol kavramı bilgisi kullanılarak soru çözülebilir. Saflık kütlece ya da yüzdece sorulmuş olabilir. Hesaplamayı doğru yaptığımız zaman iki türlü de sonuca ulaşabiliriz.
Verim Problemleri
Tepkime denklemini yazdığımız zaman normalde verimin %100 olduğunu varsayarız. Bir maddenin tükenmesi demek o tepkimenin tam verimle gerçekleşmesi demektir. Ancak gerçekte tepkimeler her zaman tam verimle gerçekleşmez. Bu durumda tepkimenin gerçekleşme oranının ve verimini yine mol kavramı yardımıyla hesaplarız.
Yukarıdaki problem türleri içerisinde çeşitli sorular gelebilir. Hatta zor soru sorulmak istendiğinde sorunun içine hem artan madde, hem saf madde hem de verim konabilir. Mol kavramını ve konunun mantığını anladığınız zaman soruları katsayıları oranlayarak rahatlıkla çözebilirsiniz.
