Periyodik Tablo Konu Anlatımı
Elementlerin atom numaralarına sıraladığı tabloya periyodik tablo denir. Periyodik tablo ilk zamanlarda atom ağırlıklarına göre dizayn edilmiş, daha sonraları atom ağırlığı aynı olan atomların bulunduğu belirlenince atom numaralarına göre düzenlenmiştir. Periyodik tabloda yatay sarılara (→) periyot ya da satır adı verilir. Düşey sıralara da grup ya da sütun adı verilir. Günümüzde aşağıdaki periyodik tablo kullanılmaktadır.
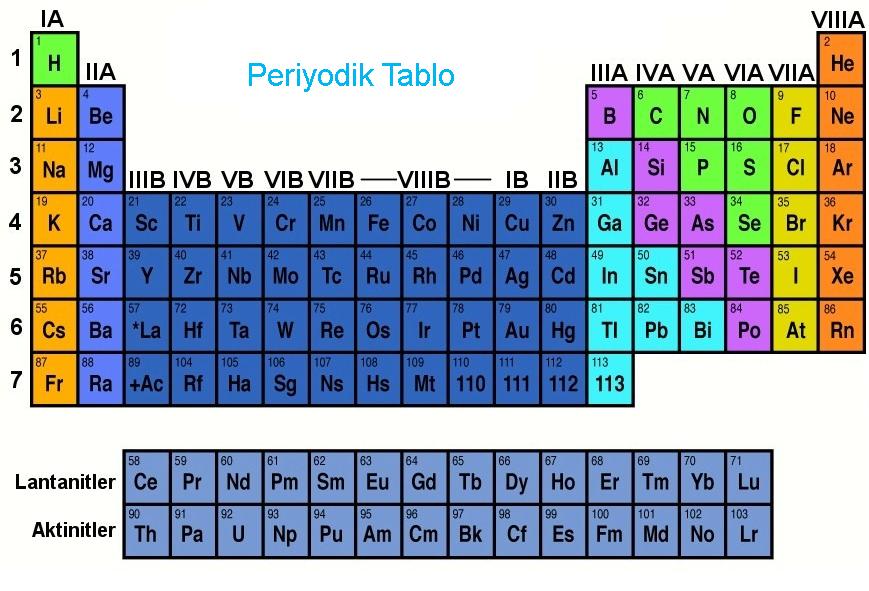
Yukarıda görüğümüz periyodik tabloda 1A ve 2A grubu s bloğu 3A, 4A, 5A, 6A, 7A, 8A grupları p bloğu, B grupları d bloğu, lantanit ve aktinitler ise f bloğudur.
| 1A grubu: | Alkali metaller |
| 2A grubu: | Toprak alkali metaller |
| 3A grubu: | Toprak metalleri |
| B grubu: | Geçiş metalleri |
| 7A grubu: | Halojenler |
| 8A grubu: | Soygazlar |
Periyodik Tablodaki Terimler
Periyodik tablo ile ilgili bir çok terim bulunur. Bu terimler elementleri guruplanlandırmamız ve özelliklerini tespit etmemiz içindir.
1. Atom Çapı
Atomların çapları karşılaştırılırken aşağdaki sıralama takip edilir.
1. Yörünge sayısına bakılır. Yörünge sayısı arttıkça elektronlar çekirdekten uzaklaşacağından atom çapı artar.
2. Eğer yörünge sayıları eşitse proton sayıları kıyaslanır. Proton sayısı büyük olanın etkin çekim gücü büyük olacağından genellikle çapı küçülür.
11Na ve 17Cl elemtlerini karşılaştırdığımızda her ikisi de 3. periyottadır. Yani yörünge sayıları eşittir. Bu yüzden atom numarası küçük olan 11Na elementinin atom çapı daha büyüktür.
Not: Periyodik tabloda, soldan sağa doğru gidildikçe atom çapı genellikle küçülür. Yukarıdan aşağıya gidildikçe çap büyür.
2. İyon Çapı
İyon çapı karşılaştırılırken atom çapının kıyaslamasında olduğu gibi periyot ve proton sayılarına bakılır. Bir atom elektron verdiğinde; elektron sayısı azalırken, proton sayısı değişmez. Elektron başına düşen çekim kuvveti artar. Bu nedenle çap küçülür.
Not: Proton sayısı değişmediğinden çekirdeğin çekim gücü değişmez.
Bir atom elektron aldığında; elektron sayısı artarken, proton sayısı değişmez. Elektron başına düşen çekim kuvveti azalır. Bu nedenle çap büyür.
Not: Atom elektron aldıkça çapı büyür, elektron verdikçe çapı küçülür.
3. İyonlaşma Enerjisi
Gaz halindeki nötr bir atomdan bir elektron koparabilmek için gerekli olan enerjiye 1. iyonlaşma enerjisi, ikinci bir elektronu koparmak için gerekli enerjiye 2. iyonlaşma enerjisi, üçüncü elektronu koparmak için gereken enerjiye de 3. iyonlaşma enerjisi adı verilir.
X + Q1 (kkal) → X+1 + e-
X+1 + Q2 (kkal) → X+2 + e-
X+2 + Q3 (kkal) → X+3 + e-
Yukarıdaki denklemlerde Q1 1. iyonlaşma enerjisi, Q2 2. iyonlaşma enerjisi, Q3 3. iyonlaşma enerjisidir.
X + Q4 (kkal) → X+3 + 3e-
Bu denklemde ise Q4 1., 2. ve 3. iyonlaşma enerjilerinin toplamına eşittir. Q4 3. iyonlaşma enerjisi değildir.
Aynı atomdan elektron koprıldıkça elektron başına düşen çekim kuvveti artacığından iyonlaşma enerjisi de artar. Bir atomun iyonlaşma enerjilerini karşılaştırılması 1. İE < 2. İE < 3. İE .... şeklindedir.
İyonlaşma enerjisi bulunurken son yörüngedeki elektron sayısına bakılır. Son yörüngesinde elektron sayısı fazla olanın genellikle iyonlaşma enerjisi daha fazladır. Son yörüngelerindeki elektron sayısı aynı ise yörünge sayısına bakılır. Yörünge sayısı fazla olanın iyonlaşma enerjisi düşüktür. Yani periyodik tabloda sağa ve yukarı doğru gidildikçe iyonlaşma enerjisi artar diyebiliriz. İki atomun hem son yörüngedeki elektron sayısı hem de yörünge sayısı aynı ise proton sayısına bakmamız gerekir. Proton sayısı fazla olanın çekirdek çekimi fazla olacağından iyonlaşma için gerekli enerji de daha yüksektir.
4. Elektron İlgisi
Gaz halindeki nötr bir atom elektron aldığında enerji açığa çıkar. Açığa çıkan bu enerjiye elektron ilgisi adı verilir.
X + e- → X-1 + E1 (kkal)
Denkleminde X atomu bir elektron alıyor ve sonucunda enerji ortaya çıkıyor. Çıkab bu enerjiye elektron ilgisi diyoruz.
Ametallerde genellikle son yörüngesinde elektron sayısı fazla olanın elektron ilgisi daha fazladır. Son yörüngelerdeki elektron sayısı eşitse yörünge saısı az olanın elektron ilgisi daha fazladır. Yani periyodik tabloda sağa ve yukarıya doğru gidildikçe elektron ilgisi artar.
5. Aktiflik
Bir elementin reaksiyona girme yatkınlığıdır. Metalik akriflik, bir elementin elektron verme eğiimidir. Ametalik aktiflik ise bir elementin elektron alma eğilimidir.
Son yörüngesinde elektron sayısı ne kadar az ise metalik aktiflik o kadar fazladır. Ayrıca yörünge sayısı fazla olanın elektron verme eğilimi daha fazladır. Örneğin, Mg ve Ca atomlarının her ikisinde de 2 elektron vardır. Ancak Ca periyodik tabloda daha alttadır. Bu da Ca'nın yörünge sayısının daha fazla olduğunu gösterir. Bu nedenle Ca Mg'ye göre daha aktiftir.
Periyodik tabloda soldan sağa doğru gidildikçe metalik aktiflik azalır. Aşağı doğru gidildiğinde ise metalik aktiflik artar. Elektron ilgisi arttıkça genellikle genellikle ametalik aktiflik artar.
Metallerin Genel Özellikleri
- Periyodik tablonun sol kısmında bulunurlar.
- Son yörüngelerinde 1, 2 ve 3 elektron bulundururlar.
- Bileşiklerin pozitif (+) değerlik alırlar.
- Kendi aralarında bileşik oluşturamazlar.
- Ametillerle iyonik bağlı bileşik oluştururlar.
- Tel ve levha haline getirilebilirler.
- Elektrik akımını iletirler.
- İyonlaşma enerjileri düşüktür.
- Elektron ilgileri yok denecek kadar azdır.
- İndirgen özellik gösterirler.
- Oksitleri genellikle bazik özellik gösterir.
- Metal atomların arasında metalik bağ vardır.
- Kendi aralarında alaşım oluştururlar.
Ametallerin Genel Özellikleri
- Periyodik tablonun sağ kısmında bulunurlar.
- Son yörüngelerinde 5, 6, 7 elektron bulundururlar.
- Bileşiklerinde pozitif (+) ve negatif (-) değerlik alırlar.
- Metallerle iyonik bağlı bileşik oluştururlar.
- Kendi aralarında kovalent bağlı bileşik oluştururlar.
- Tel ve levha haline getirilemezler.
- İyonlaşma enerjileri yüksektir.
- Elektron ilgileri yüksektir.
- Yükseltgen özellik gösterirler.
- Katı, sıvı, gaz hallerinde bulunabilirler.
- Elektrik akımını iletmezler (Grafit hariç).
- Oksitleri genellikle asidik karakterlidir.
Soygazların Genel Özellikleri
- Periyodik tablonun en sağ sütununda yer alırlar.
- Helyum (He) hariç son yörüngelerinde 8 elektron vardır.
- Bileşik oluşturmuzlar.
- İyonlaşma enerjileri çok yüksektir.
- Elektron ilgisi göstermezler.
- Gaz fazındadırlar ve tabiatta atomik yapıda bulunurlar.
- Elektrik akımını iletmezler.
Not: Bu konuda gördüğümüz kavramların ezberlenmemesi gerekir. Bu kavramların mantığının kavranması çok önemlidir. Aksi takdirde unutmak kolay olacaktır.
Çok güzel bir çalışma olmuş tebrik ederim sizin sayenizde konuyu daha iyi anladım tekrardan teşekkürler
