Madde ve Özellikleri
Kütlesi, hacmi ve eylemsizliği olan her şeye madde denir. Buna göre kütle ve hacim maddenin ortak özelliklerindendir. Çevremizde gördüğümüz hava, su, toprak vs. her şey maddedir. Maddeler tabiatta katı, sıvı, gaz olmak üzere üç halde bulunurlar.
Katı halde, atomlar ya da moleküller arasında çekim kuvveti bir hayli fazladır ve her maddenin bir şekli vardır. Maddenin en kararlı hali katı halidir. Sıvı halde, moleküller katıya göre daha kararsızdırlar ve madde akışkan özellik kazanmıştır. Gaz halinde ise, moleküller arasında çekim kuvveti yok denecek kadar azdır. Maddenin en kararsız hali gaz halidir.
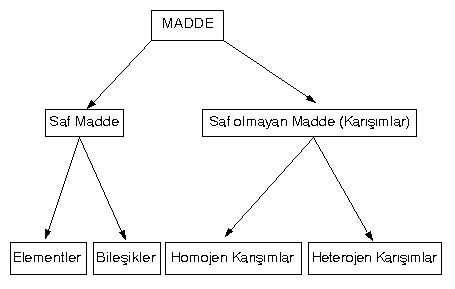
Maddenin sınıflandırılması
Element
Tek cins atomdan oluşmuş saf maddeye element denir. Magnezyum (Mg), Oksijen (O) gibi.
Elementler
- Homojendirler (Özellikleri her yerde aynıdır).
- Belirli erime ve kaynama noktaları vardır.
- Yapı taşı atomdur.
- Kimyasal ve fiziksel yollarla daha basit parçaya ayrılamazlar.
Bileşik
Birden fazla elementin belirli oranlarda bir araya gelerek, kendi özelliklerini kaybedip oluşturdukları yeni saf maddeye bileşik denir. Örneğin; iki hidrojen (H) atomuyla, bir oksijen (O) atomu bir araya gelerek su bileşiğini (H2O) oluşturur.
Bileşikler
- Homojendirler.
- Belirli erime ve kaynama noktaları vardır.
- Fiziksel yollarla bileşenlerine ayrılamazlar.
- Yapı taşı moleküldür.
- Belişiği oluşturan elementler sabit kütle oranıyla birleşirler. Bu oran değişirse başka bir bileşik oluşur.
- Kimyasal özellikleri kendisini oluşturan elementlerin özelliğine benzemez.
- Formüllerle gösterilirler.
- Yapısında en az iki cins atom vardır.
Karışım
Birden fazla maddenin her türlü oranda (rastgele oranlarla) bir araya gelerek, kimyasal özelliklerini kaybetmeden oluşturdukları topluluğa karışım denir. Karışımda maddeler fiziksel özelliklerini kaybedebilirler.
Karışımlar
a. Homojen karışım
Özellikleri her yerde aynı olan karışımlardır. Örneğin; çözeltiler, alaşımlar, gaz karışımları vs.
b. Heterojen Karışım
Özellikleri her yerde aynı olmayankarışımlardır. Aklınıza gelen basit karışımların çoğu heterojendir. Heterojen karışımlar süspansiyon ve emülsiyon olmak üzere ikiye ayrılır.
Süspansiyon: Katı + Sıvı heterojen karışımların özel adıdır. Bir katının sıvı içinde çözünmeden kalmasına denir.
Emülsiyon: Sıvı + Sıvı heterojen karışımların özel adıdır. Zeytin yağı su karışımı bir emülsiyondur.
Karışımların Özellikleri
- Karışımlarda maddeler kendi özelliklerini korurlar.
- Karışımlar fiziksel yollarla bileşenlerine ayrılabilirler.
- Erime ve kaynama noktaları sabit değildir.
- Homojen ya da heterojen olabilirler.
- Yapısında en az iki cins atom vardır.
- Saf değildirler.
- Formülleri yoktur.
- Maddelerin birleşmesinde belirli bir oran yoktur.
Maddedeki Değişmeler
a. Fiziksel Değişmeler
Maddenin dış yapısıyla ilgili özelliklerine fiziksel özellik, dış yapısıyla ilgili değişmelere de fiziksel değişme denir. Bir maddenin rengi, kokusu, tadı gibi özellikleri fiziksel özellikleridir. Bu özelliklerin değişmesi fiziksel değişmedir.
b. Kimyasal Değişmeler
Maddenin iç yapısıyla ilgili değişmelerdir. Kimyasal değişmelerde atomların çekirdek yapısı değişmez (radyoaktif bozunmalar hariç). Elektronlar alınır, verilir ya da ortak olarak kullanılır. Kimyasal reaksiyonlarda kütle korunur.
Ayır Edici Özellikler
Miktara bağlı olmayan, sadece o maddeye has olan özelliklere ayırt edici özellikler denir.
a. Özkütle (Yoğunluk)
Bir maddenin birim hacimdeki kütlesidir. d = M/V olarak ifade edilir. Birçok madde için birim gr/cm3'tür. Yani bir maddenin 1 cm3'nün kütlesi o maddenin özkütlesidir.
♦ Fakat bazı durumlarda yoğunluk ayırt edici özellik olmayabilir. Yani birkaç madde aynı yoğunluğa sahip olabilirler.
b. Erime ve Kaynama Noktaları
Saf maddeler için ayırt edici özelliktir. Element ve bileşiklerin belirli erime ve kaynama noktaları vardır. Fakat saflık bozulduğunda erime ve kaynama noktalarının sabitliği bozulur. Mesela tuzlu su, saf suya göre daha yüksek sıcaklıkta kaynar. Kaynama süresince sıcaklığı artar. Tuzlu su yine normal suya göre daha düşük sıcaklıkta donar.
Bir gaz maddenin, sıva hale dönüştüğü sıçaklığa yoğunlaşma noktası denir. Buna göre; kaynama noktası ile yoğunlaşma noktası eşittir diyebiliriz.
c. Çözünürlük
Belirli bir sıçaklıkta 100 gram çözücüde çözünebilen maksimum madde miktarıdır. Her maddenin değişik çözücülerde çözünürlüğü farklıdır. Genelleme yapmak gerekirse; polar maddeler polar çözücülerde, apolar maddeler ise apolar çözücülerde daha iyi çözünür. Katıların çözünürlüğü sıcaklığın artmasıyla genellikle artarken, gazların çözünürlüğü sıcaklığın artmasıyla azalır. Bazı katıların katıların çözünürlüğü sıcaklıkla değişmezken, bazılarının çözünürlüğü sıcaklık arttıkça azalır.
d. Esneklik
Dışardan bir kuvvetin etkisiyle maddenin esneme miktarıdır. Katılar için ayırt edici bir özelliktir. Sıvı ve gazlar için ayırt edici değildir.
e. Genleşme
Isı etkisiyle katı ve sıvıların hacmindeki artma oranıdır. Gazlar için kesinlikle ayırt edici özellik olamaz. Çünkü bütün gazlar sıcaklık karşısında aynı oranda genleşirler.
f. Öz ısı
Bir maddenin 1 gramının sıcaklığını 1 °C arttırmak için gerekli olan ısı miktarıdır. Maddeler için ayırt edici bir özelliktir. Bir maddenin katı, sıvı ve gaz hallerinin her biri için öz ısısı farklıdır.
g. İletkenlik
Maddenin elektrik akımı iletkenliklerine bakarak da ayırabiliriz. Bununla ilgili şu noktaların bilinmesinde fayda vardır;
- İyonlu çözeltiler (Asit, baz, tuz çözeltileri) elektrik akımını iletirler.
- Moleküler çözeltiler (Şekerli su, alkol + su çözeltileri) elektrik akımını iletmezler.
- Metaller elektrik akımını iletir. Ametaller iletmez. Metalin elektirii iletmesi fiziksel bir özelliktir.
Not: Bütün bu ayırt edici özellikle fiziksel ayırt edici özelliklerdir. Maddenin kimyasal ayırt edici özellikleri de vardır.
