Kimyasal Bağlar
Atom ve molekülleri bir arada tutan kuvvetlere kimyasal bağ denir. Kimyasal bağlar kimyevi varlıkları bir arada tutan kuvvetlerdir. Her bileşiği elementlerine ayırmak farklı miktarda enerji gerektirir. Bu moleküllerin bağlarının sağlamlıklarının farklılığından kaynaklanır. Yine her maddenin erime ve kaynama noktaları farklıdır. Bu da maddelerin molekülleri arasındaki çekim kuvetlerinin farklılığından kaynaklanır. Kimyasal bağları şöyle sınıflandırabiliriz.
Kimyasal Bağlar ve Türleri
Kimyasal bağlar temel düzeyde ikiye ayrılır.
- İyonik Bağ
- Kovalent Bağ
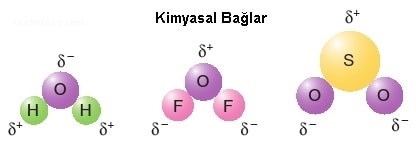
Şimdi de yukarıda adını zikrettiğimiz kimyasal bağları kısaca tanıyalım.
İyonik Bağ
İyonlar arasında elektrostatik (+, - çekimi) çekimle oluşur. Bir başka ifadeyle elektron alış verişi sonucu oluşan iyonlar arasındaki elektrostatik çekimdir.
Bu şekilde oluşan (+) ve (-) yükler bir birini büyük bir kuvvetle çekerler. Bundan dolayı iyonik bağlı bileşikleri ayrıştırmak çok zordur. Bu (+) ve (-) yüklü iyonlar arasındaki boşluklar son derece azdır. Oda koşullarında katı halde bulunurlar. Katı halde elektriği iletmeyip sıvı ya da çözeltileri elektrolittir. İyonik katılarda (+) ve (-) katı içerisinde belirli bir düzen içerisinde yerleşerek belirli bir kristal yapı oluştururlar.
Örneğin; NaCl, NaNO3, MgCl2 gibi bileşikler iyonik bağlı bileşikleridir. Bu bileşiklerin arasındaki kimyasal bağlar elektron alıp vermeyle kurulur.
11Na ile 9F arasında oluşan bağın yapısını şöyle inceleybiliriz.
11Na: 1s2 2s2 2p6 3s1
9F: 1s2 2s2 2p5
Bu elementlerin elektronik yapıları incelenirse, 11Na metal, 9F de ametaldir. Na bileşik oluştururken bir elektronunu vererek, F'de bir elektron alarak soygaz kararlığına ulaşır. Bu iki atom arasında bağ oluştururken, Na'nın son yörüngesindeki tek elektronu F'nin yarı dolu orbitaline aktarılır. Bu şekilde NaF bileşiği oluşur.
NaF(k) → Na+(aq) + F-(aq) şeklinde iyonlaşır ve sulu çözeltisi elektriği iletir.
Kovalent Bağ
Bağı oluşturan atomlar arasında elektronların ortak kullandığı bağ türüdür. Ametal atomları kendi aralarında bağ oluştururken elektron alışverişinde bulunmayıp elektronlarını ortaklaşa kullanırlar. Bunun sonucunda kovalent bağlar meydana gelir. Bir ametal atomu son yörüngesinde bulunan yarı dolu orbital sayısınca elektronu ortaklaşa kullanarak kovalent bağ oluşturur. Soygazlar ne kendi aralarında ne de başka atomlarla bağ oluşturamamazlar. Çünkü yarı dolu orbitalleri yoktur. Aynı iki atomun kovalent bağ oluşturmasıyla apolar kovalent bağ oluşur. Farklı cins iki atomun kovalent bağ oluşturmasıyla da polar kovalent bağ oluşur. Örneğin O2 molekülünde iki oksijen arasında apolar kovalnet bağ varken NO molekülünde oksijen ile azot arasında polar kovalent bağ vardır.
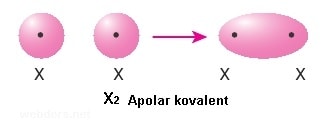
Kimyasal bağlar içerisinde en önemlileri iyonik ve kovalent bağlardır. Ancak fiziksel bağ dediğimiz moleküller arası bağlar da mevcuttur.
