Atom ve Yapısı
Kimya dersi için atomu tanımak, atom ve yapısı hakkında bilgi sahibi olmak çok önemlidir.
Atomla İlgili Teoriler
Atomla ilgili zamanla birçok teori ortaya atılmıştır. Bu teoriler geliştikçe bilginin doğruluğu da artmıştır.
Dalton Atom Teorisi
- 19. yüzyılın başlarında J. Dalton, şu teorileri ortaya atmıştır.
- Bir element, aynı büyüklükte, aynı ağırlıkta atom adı verilen içi dolu küçük küreciklerden ibarettir.
- Aynı elementteki atomların gösterdiği özellikler aynıdır. Farklı elementlerin atomları farklı özellik gösterir.
- Atomlar parçalanamaz.
- Elementler bileşik oluştururken belirli sayı ve kütle oranlarında birleşirler.
Fakat günümüzde, atomun parçalanabildiği, elementin bütün atomlarının aynı olmadığı (izotoplar) ve atomun içi dolu bir küre olmadığı anlaşılmıştır.
Thomson Atom Teorisi
J. Thomson tarafından hazırlanan düzenekte; negatif elektrot (katot) elektron yayar. Yayılan elektronlar havası boşaltılmış tüp içinde sağa doğru hızlandırılır. Elektronların bir kısmı pozitif yüklü elektrot (anot) tan geçerek ZnS yüzeyine çarpar. Çarpma esnasında yüzey parlar. Bu deney sonucunda;
- Atomda pozitif (+) ve negatif (-) yükler vardır.
- (+) ve (-) yükler atomun her tarafında dağınık bir şekilde bulunur.
Thomson''un bahsettiği atomun şekli üzümlü keke benzediği için Thomson''un atom modeline üzümlü kek modeli de denmiştir. Thomson''un atom teorisinde + yüklerin dağınık bir şekilde bulunduğunu söylemesi ve nötrondan bahsetmemesi teorisinin eksik yönüdür.
Rutherford Atom Teorisi
E. Rutherford''un deney düzeneğinde,
Radyoaktif alfa (α) ışın kaynağı Polonyum (Po) elementinden gelen ışınlar kurşun levhadan geçip ince altın levhaya düşürüldüğünde ışınların çok büyük bir kısmının geçtiği çok az bir kısmının geri döndüğü gözlenmiştir.
Bunun sonucunda Rutherford,
- Atomun büyük bir kısmı boşluktur.
- Atomda pozitif (+) yükler çok küçük bir hacimde toplanmıştır. Eksi (-) yükler dağınıktır.
Günümüzdeki atom modeline yaklaşarak ilk defa çekirdek fikrini ortaya atmıştır. Elektronların neden çekirdeğe yapışmadığını açıklayamamıştır.
Bohr Atom Teorisi
- Elektronlar hem kendi ekseni etrafında hem de çekirdek etrafında dairesel yörüngede dönerler.
- Elektronlar çekirdekten belli uzaklıkta bulunurlar. Her uzaklığın kendine özgü bir enerjisi vardır.
- Bir yörüngedeki elektronu diğer yörüngeye çıkarmak için enerji gerekir.
- Yüksek enerjili yörüngüde düşük enerjili yörüngeye dönerken enerji farkı ışık ya da ısı olarak verilir.
Bu teorinin eksik yönü ise elektronların belirli yörüngelerde bulunduğu söylemesidir. Fakat, elektronlar hızlı tanecikler olduğundan ayrı ayrı hızını ve yerini tespit edemeyiz.
Bahsettiğimiz bu 4 teori model olarak aşağıdaki şekilde özetlenmiştir.
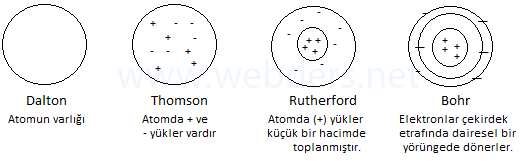
Modern Atom Teorisi
19. yüzyılın başlarından itibaren atomla ilgili çalışmalar neticesinde modern atom teorisi ortaya konmuştur. Teoriye göre;
Elektronların kütlesi çok küçük, hızı çok büyük olduğundan elektronun yeri tam olarak bilinemez. (Heisenberg''in belirsizlik prensibi)
Elektronlar dalga özelliği gösterir.
Elektronların bulunma olasılığının fazla olduğu yerlere orbital adı verilir.
Örnek:
Atomda ilk defa çekirdek fikrini ortaya atan bilim adamı kimdir?
A) J. Dalton B) J. Thomson C) E. Rutherford D) N. Bohr E) J. Chadwick
Çözüm
Rutherford ilk defa protonların (+ yüklü taneciklerin) küçük bir hacimde toplandığını, elektronların (-) rastgele hareket ettiğini söylemiştir.
(Cevap C)
Atom ve Atomla İlgili Terimler
Fiziksel ve kimyasal yollarla parçalanamayan, elementin bütün özelliklerini üzerinde taşıyan en küçük birime atom denir. Demir (Fe), Bakır (Cu) ve Altın (Au) gibi elementler incelendiğinde, atom adı verilen çok küçük taneciklerden oluştuğu gözlenir.
Atom iki kısımdan oluşmaktadır:
- Çekirdek
- Yörünge
Çekirdekte proton ve nötronlar, yörüngelerde ise elektronlar bulunur.
| Çekirdek | Yörünge | ||
| Proton | Nötron | Elektron | |
| Simgesi | p | n | e- |
| Yükü | +1 esyb* | yüksüz (0) | -1 esyb |
| Kütlesi | 1 akb* | 1 akb | 1/1840 akb |
* esyb : Elektrostatik yük birimi
* akb : Atomik kütle birimi (1 akb = 1,67.10-24 gram)
Atom Numarası
Herhangi bir atomun çekirdeğinde bulunan proton sayısıdır. Her atomun kendine özgü protonsayısı vardır. Atomları birbirinden ayırmak için öncelikle proton sayısına bakılır. Atomun çekirdeğinde yük sadece protonlara ait olduğundan, proton sayısına aynı zamanda çekirdek yükü de denir. O halde,
Atom numarası = Çekirdek yükü = Proton sayısı
Kütle Numarası
Bir atomun kütle numarası; atomun proton ve nötron sayıları eşittir.
Kütle numarası = Proton sayısı + nötron sayısı
Nötr Atom
Proton sayısı (p), elektron sayısına (e-) eşit olan atomdur. Örneğin, 6C, 12Mg, 3Li gibi.
Nötr atomlarda p = e- dir.
İyon
Elektron almış ya da vermiş taneciklerdir. Pozitif (+) veya (-) değer almış atom ya da atom gruplarıdır. İyonlarda ptoron sayısı ile elektron sayısı eşit değildir. İyonlar nötr değildir. Örneğin, Ca+2, F-1, OH- gibi. İyonlarda elektron sayısı ile iyon yükünün toplamı proton sayısını verir.
Atom numarsı = Elektron sayısı + yük
İki tür iyon vardır.
Katyon
Elektron vererek pozitif (+) yükle yüklenmiş atom ya da atom gruplarıdır. Örneğin, Cr+1 gibi.
Katyonlarda proton sayıları elektron sayılarından büyüktür. Yani p > e- dir. Örneğin 12Mg+2 iyonunda 10 elektron bulunur.
Anyon
Elektron alarak negatif (-) yük ile yüklenmil atom ya da atom gruplarıdır. Örneğin, O-2 gibi. Anyonlarda proton sayısı elektron sayısından küçüktür. Yani p < e- dir. Örneğin 17Cl- iyonunda 18 elektron vardır.
Örnek:
Kütle numarası 31 olan P-3 iyonunda 18 elektron vardır. Forforun (P) nötron sayısı kaçtır?
Çözüm
Proton sayısı = elektron sayısı + yük yük = -3, elektron sayısı = 18 ⇒proton sayısı = 15
Kütle numarası = proton sayısı + nötron sayısı proton sayısı =15 kütle numarası = 31 ⇒nötron sayısı = 16
İzoelektronik
Elektron dağılı ve sayısı eşit olan teneciklerdir. Örneğin 12Mg+2 iyonu ile 8O-2 iyonunun elektron sayıları birbirine eşittir. Her iksinin de 10 tane elektronu vardır. İyonlar izoelektroniktir. İzoelektronik iyonların kimyasal özellikleri birbirine benzerdir.
İzobar
Kütle numaraları aynı, atom numaraları farklı olan atomlardır. Örneğin 24Mg - 24Na atomlarından ikisinde kütle numarası 24 ve Mg 12 atom numarasına sahipken Na 11 atom numarasına sahiptir. Bu yüzden bu iki atom izobardır. İki atomun izobar olması kimyasal özellikleri ile ilgili bize herhangi bir fikir vermez.
İzoton
Nötron sayıları aynı olan, atom numarası farklı olan atomlardır.
İzotop
Proton sayıları aynı (atom numaraları), kütle numaraları farklı olan atomlardır. Bu atomların proton sayısı aynı olduğu için farklı kütle numaralarından dolayı farklı nötron sayılarına da sahip oldukları kolaylıkla anlaşılabilir. Örneğin 35Cl - 37Cl atomlarının her ikisinde atom numarası 17 olmasına rağmen kütle numaraları farklıdır. Bu iki atom izotop atomdur.
35Cl %75 oranında 37Cl oranında doğada bulunmaktadır. Bu atomun ortalama atom ağırlığı şu şekilde hesaplanabilir.
O.A.A = 35.75/100 + 37.25/100 = 35,5 gr/mol
İzotop atomların özellikleri
- Kimyasal özellikleri aynıdır.
- Fiziksel özellikleri farklıdır.
- Ortalama atom ağırlıkları kesirlidir.
- Oluşturdukları bileşiklerin mol ağırlıkları farklıdır.
Allatrop
Bir maddenin farklı şekilde dizilmesiyle oluşan farklı maddelere allotrop denir. Örneğin elmas ve grafit karbon elementinin farklı dizilmesiyle oluşan alloptrop madddelerdir.
Allotrop maddelerin özellikleri
- Reaksiyona girme aktiviteleri farklıdır.
- Fiziksel özellikleri farklıdır.
- Uzaydaki dizilişleri farklıdır.
- Reaksiyona girdikleri madde aynı ise aynı ürünü oluştururlar.
Örnek:
Rombik kükürt ve monoklinik kükürt birbirinin allotropudur.
Buna göre;
I. Fiziksel özellikleri
II. Yapısındaki atomların cinsi
III. kristal yapıları
ifadelerinden hangileri rombik kükürt ve monoklinik kükürt için aynıdır?
Çözüm
Aynı atomun farklı şekilde dizilmesiyle oluşan maddler birbirinin allotropudur. Buna göre fiziksel özellikleri farklıdır, yani I. öncül yanlıştır. II. öncül maddeleri oluşturan atomlar aynı olduğu için doğrudur. Uzaydaki dizilişleri tani kristal yapıları farklıdır. Dolayısıyla III. öncül yanlıştır.
Elektron Dağılımı
Elektron dağılı iki şekilde yapılır.
- Pauli prensibine göre
- Elektronik konfigüresyona göre
Pauli Prensibi
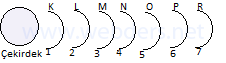
Çekirdeğin çevresinde 1, 2, 3 .. 7 yörünge vardır. Ya da K, L, M, ... R diye gösterilebilir.
Puali''ye göre; n → yörünge numarası olmak üzere; yörüngelerdeki maksimum elektron sayısı 2n2 formülü ile bulunur.
n = 1 ⇒ 2e-
n = 2 ⇒ 8e-
n = 3 ⇒ 18e-
n = 4 ⇒ 32e-
Son yörüngelerde maksimum 8 elektron bulunur. Herhangi bir atom düşünelim. Atomun çekirdeği ve çevresinde yörüngeleri vardır.
Yörüngelerde bulunabilecek maksimum elektron sayıları
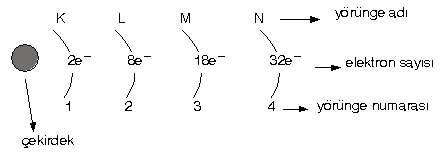
şeklinde gösterilebilir.
Yörünge sayısı, periyot numarasını olarak adlandırılır. A grubunda son yörüngedeki elektron sayısı grub numarası olarak da ifade edilebilir.
Örnek:
11Na elementinin periyodik tablodaki yerini bulunuz.
Çözüm
11Na elementinin elektron dağılımı yazıldığında 2 8 1 şeklindedir. 3 yörüngesi olduğu için 3. periyot 1A grubundadır.
Elektronik Konfigürasyon (Modern Atom Teorisi)
Modern atom teorisine göre elektronun bulunma ihtimalinin en yüksek olduğu hacime orbital denir. 4 tür orbital çeşidi vardır. Bunlar s, p, d, f şeklinde adlandırılır. s de 1, p 3, d de 5 f de ise 7 orbital vardır. Her orbitale en fazla 2 elektron yerleşir. Yerleşen elektronların spini (yön) ters olmalıdır.
Buna göre s orbitali en fazla iki elektron, p orbitali en fazla 6 elektron, d orbitali en fazla 10 elektron ve f orbitali en fazla 14 elektron alır.
Elektronlar orbitallere yerleştirilirken enerjisi düşük olan tercih edilir. Sırasıyla her orbitale birer tane yerleştirilir. Artan elektronlar baştan itibaren tekrar yerleştirilir. Elektronları orbitallere yerleştirirken bu kurala dikkat etmek gerekir.
Çekirdeğe en yakın orbitalin potansiyel enerji seviyesi en düşüktür. Orbitallerin enerji seviyelerine göre sıralanması için aşağıdaki tablodan yararlanılarak elektronların orbitallere yerleştirilmesi şu şekilde bulunur.
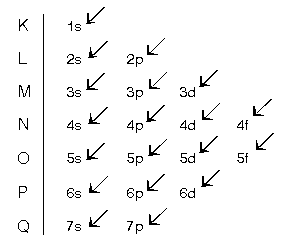
1s22s22p63s23p64s23d104p65s24d10 ... şeklindedir.
Örnek olarak nötr 6C atomunun elektron dizilmini gösterelim.
![]() görüldüğü gibi elektronlar p orbitallerine sırayla dizilirler.
görüldüğü gibi elektronlar p orbitallerine sırayla dizilirler.
Şimdi de orbitalleri tam dolu olan 10Ne atomunun elektron dizilimini gösterelim.
![]()
Örnek olarak yazılan konfigürasyonlardan herhangi birini inceleyelim.
4s2 ile biten bir dağılımda 4 başkuant sayısı, s orbital türü, 2 ise orbitaldeki elektron sayısıdır.
Elektronik konfigürasyon yardımıyla
- Periyot sayısı
- Grubu
- Elementlerin sınıflandırılması
- Değerlik elektron sayısı
- Tam dolu, yarı dolu orbital sayısı bulunabilir.
Periyot Sayısı (En Büyük Baş Kuant Sayısı)
Elektronik konfigürasyondaki en büyük katsayıdır. Örneğin X : 1s2 2s2 2p6 3s2 3p6 4s2 3d1 de en büyük katsayı 4 tür. Demekki X 4. periyottadır.
Grubu
Elektronik konfigürasyondaki son orbitale göre tanımlanır.
Son orbital s veya p ise A grubu, d veya f ise B grubu.
| son orbital | s1 ise 1A |
| son orbital | s2 ise 2A |
| son orbital | p1 ise 3A |
| son orbital | p2 ise 4A |
| son orbital | p3 ise 5A |
| son orbital | p4 ise 6A |
| son orbital | p5 ise 7A |
| son orbital | p6 ise 8A |
Elektron dağılımı f ile bitiyorsa lantanitler veya aktinitlerdir.
| son orbitaller | s2d1 ise 3B |
| son orbitaller | s2d2 ise 4B |
| son orbitaller | s2d3 ise 5B |
| *son orbitaller | s1d5 ise 6B |
| son orbitaller | s2d5 ise 7B |
| son orbitaller | s2d6 ise 8B |
| son orbitaller | s2d7 ise 8B |
| son orbitaller | s2d8 ise 8B |
| **son orbitaller | s1d10 ise 1B |
| son orbitaller | s2d10 ise 2B |
* 6B grubunun elektronik konfigürasyonu s2d4 ile bitmesi gerekirken küresel simetriden dolayı s2 deki bir elektron d4 ü yarı kararlı hale ulaştırarak s1d5 haline dönüşür.
** 1B grubunun elektronik konfigürasyonu s2d9 ile bitmesi gerekirken küresel simetriden dolayı s2 deki bir elektron d9 u yarı kararlı hale ulaştırarak s1d10 haline dönüşür.
Uyarılma: Atomların temel halde bulunan elektronlarının dışarıdan enerji verilerek daha yüksek enerjili orbitallere çıkması olayıdır.
11Na: 1s2 2s2 2p6 3s1 (Temel hal)
11Na: 1s2 2s2 2p6 4s1 (Uyarılmış hal)
Not: ns2 (n - 1)d4 ün ns1 (n - 1)d5 olması uyarılma değildir. ns2 (n - 1)d9 un ns1 (n - 1)d10 olması uyarılma değildir.
Örnek:
29Cu elementinin s orbitalinde toplam kaç elektron vardır?
Çözüm
Elektron dağılımı yazıldığında;
19Cu: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 şeklinde yazmak hatalıdır. Doğrusu, elektron dağılımı 4s2 den 1 elektron 3d9 a aktarılır.
1s2 2s2 2p6 3s2 3p6 4s1 3d10 şeklinde olur. O halde s orbitallerinde toplam 7 elektron olacaktır.
Elementlerin Sınıflandırılması
| Metal | Ametal | Soygaz |
| 1A, 2A, 3A | 4A, 5A, 6A, 7A | 8A |
Hidrojen 1A grubunda yer alır ancak ametalik özellik gösterir. 4A ki beş element üç farklı özellik gösterdiğinden genel bir sınıfı yoktur. Fakat C (karbon) ametaldir. B grubu geçiş metalleridir. Elektronik konfigürasyon 4 f ile biterse lantanit, 5 f ile biterse aktinit olarak sınıflandırılır.
Değerlik elektron sayısı
Grup numarası olarak tanımlanır. Örneğin, 5A grubundaki X in değerlik elektron sayısı 5 dir. 5B grubundaki Y nin değerlik elektron sayısı 5 dir.
Elementlerin bileşiklerinde aldıkları değerlikler
Metaller elektron vermeye yatkın olduğundan 1A grubu metalleri bileşiklerinde +1 2A grubu metalleri bileşiklerinde +2 3A grubu metalleri bileşiklerinde +3 değerlik alırlar.
Not: B grubu metalleri genelde bileşiklerinde değişken pozitif değerlik alırlar.
Ametaller bileşik oluştururken genellikle elektron alırlar. Ancak (+) değerlik aldıkları bileşikleri de bulunur. Dolayısıyla,
5A grubu -3, ... +5
6A grubu -2, ... +6
7A grubu -1, ... +7
değerliklerini alırlar.
Soygazlar son yörüngedeki orbitalleri tam dolu olduğundan ne elektron alırlar ne de verirler. Dolayısıyla değerlikleri yoktur.
Not: Flor ametali bileşiklerinde daima -1 değerliklidir. Oksijen ametali bileşiklerinde OF2 hariç + değerlik almaz.
Özkan güray'ın tüm ygs videolarını nereden bulabilirim kimyayı bir tek ondan anlıyorum acilen yardımcı olursolursanız çok sevinirim şimdiden teşekkür ederim
