Reaksiyon Hızı
Tepkime Hızı, Ortalama Hız ve Anlık Hız
Kimyasal tepkime hızları da diÄŸer alanlardaki gibi, bir özellikteki deÄŸiÅŸimin, deÄŸiÅŸimin olduÄŸu zamana bölümü olarak tanımlanabilir. Kimyasal tepkimelerde girenlerin ne kadar hızla tüketildiÄŸi veya ürünlerin ne kadar hızla oluÅŸtuÄŸu tepkimelerin hızını oluÅŸturmaktadır. Bir kimyasal tepkime, tepkimeye girenlerin zamanla ürünlere dönüÅŸtüÄŸü bir süreçtir. Bu süreçte girenlerin miktarı azalırken, ürünlerin miktarı artar. Tepkime ilerledikçe, tepkimeye katılanların ürünlere dönüÅŸüm hızı azalır.
Tepkime hızı, belirli bir zaman aralığında oluşan derişim değişimidir.
Girenler esas alınmışsa deriÅŸimdeki azalmadan, ürünler esas alınmışsa deriÅŸimdeki artmadan bahsedilebilir.
Tepkime hızı = Derişimdeki değişim / Zaman aralığı
Burada bahse konu olan hız, ortalama hızdır. Belirli bir zaman aralığında deriÅŸimdeki deÄŸiÅŸimin, zamandaki deÄŸiÅŸime oranına reaksiyonun ortalama hızı denir. Reaksiyonun ortalama hızını formülle göstermek gerekirse, aÅŸağıdaki bağıntı ortaya çıkar:
rort = Δc / Δt
Reaksiyonun anlık hızı, zamana karşı deriÅŸimin grafiÄŸe geçilmesi ile elde edilen eÄŸriye t anında çizilen teÄŸetin eÄŸimidir. Reaksiyon ilerledikçe anlık hız deÄŸiÅŸir. Anlık hızın formüle edilmesi aÅŸağıdaki gibi olur:
c(t) = dc / dt
Tepkime Hızınnın Ölçülmesi
Uygulamada tepkime hızını ölçmek için tepkimenin baÅŸladığı ve bittiÄŸi zaman aralığı belirlenmelidir. Tepkimeye giren maddelerin miktarındaki azalma veya ürünlerin miktarındaki artma direk gözlenemediÄŸi için tepkimedeki bazı özelliklerin zamanla deÄŸiÅŸimi gözlenerek sonuca ulaşılabilir. Bu özellikler; renk deÄŸiÅŸimi, iletkenlik deÄŸiÅŸimi, basınç deÄŸiÅŸimi, pH deÄŸiÅŸimi, ısı deÄŸiÅŸimi, çökelme, hacim deÄŸiÅŸimi ve ışık olabilir. Yaygın olarak renk deÄŸiÅŸimi, iletkenlik deÄŸiÅŸimi, basınç deÄŸiÅŸimi ve pH deÄŸiÅŸimi araç olarak kullanılır.
1. Basınç deÄŸiÅŸimi ile
Basınç deÄŸiÅŸiminin araç olarak kullanılabilmesi için tepkimede gazların olması ve gazların mol sayılarının deÄŸiÅŸmesi gerekir. Sabit sıcaklık koÅŸulunda hacim sabit tutularak basınç deÄŸiÅŸimi veya basınç sabit tutularak hacim deÄŸiÅŸimi gözlem aracı olarak kullanılabilir.
A + B → 2C tepkimesinde basınç veya hacim deÄŸiÅŸimi araç olarak kullanılamaz. Nedeni ise girenlerin katsayıları toplamının ürünlerin katsayıları toplamına eÅŸit olmasıdır.
A + B → C türündeki tepkimelerde ise basınç deÄŸiÅŸimi ile reaksiyon hızı ölçülebilir. Çünkü girenlerin katsayıları toplamı 2, ürünlerin katsayı toplamı ise 1'dir. Sabit sıcaklık ve hacim altında basınç azalacaktır. Basınçdaki azalma gözlenerek tepkime hızı hakkında fikir sahibi olunabilir.
2. Ä°letkenlik deÄŸiÅŸimi ile
Ä°letkenlik deÄŸiÅŸiminin araç olarak kullanılması için çözelti ortamında gerçekleÅŸen tepkimelerde iyonların deriÅŸimi deÄŸiÅŸmelidir. ÖrneÄŸin;
Ag+(aq) + Cl-(aq) → AgCl(k) tepkimesinde iyonların deriÅŸimi zamanla azalacak, buna baÄŸlı olarak iletkenlikte azalacaktır. Ä°letkenlikteki azalma gözlenerek tepkime hızı ölçülebilir.
3. Renk deÄŸiÅŸimi ile
Renk deÄŸiÅŸiminin gözlenebilmesi için tepkimede renkli maddeler bulunmalı ve zamanla renk deÄŸiÅŸmelidir. Ürünlerin ve girenlerin renkleri farklı ise renk dönüÅŸümünün hızından tepkime hızını da görebiliriz.
4. pH deÄŸiÅŸimi ile
pH deÄŸiÅŸiminin araç olarak kullanılabilmesi için tepkime H+ veya OH- iyonları olmalı ve bu iyonların deriÅŸimi deÄŸiÅŸmelidir.
Çarpışma Teorisi
Kimyasal tepkimeler, bir baÄŸ düzenindeki taneciklerin (atom, iyon molekül) yeni bir baÄŸ düzenine geçmesidir. Bir baÅŸka ifade ile baÄŸlar kırılır ve yeni baÄŸlar oluÅŸur.
Bir tepkimenin baÅŸlayabilmesi için maddelerin bir araya getirilmesi gerekir. Bir baÅŸka ifade ile taneciklerin çarpışması gerekir. Asitler ve bazlar bir araya getirilince kendiliÄŸinden tepkime verir. Ancak, öncelikle bir araya getirilmesi gerekir.
Tanecikler arasındaki her çarpışma tepkime ile sonuçlanmaz. Bir kapta bir arada bulunan metan gazı ve hava birbiri ile tepkime vermez. Bunun için bir kıvılcım gerekir. Her tepkimenin baÅŸlaması için gerekli olan enerji farklıdır. Taneciklerin enerjilerinin toplamı, tepkimenin baÅŸlaması ve devam etmesi için yeterli deÄŸilse tepkime gerçekleÅŸmez.
Enerjisi yeterli olmadığı için çarpışmalarına raÄŸmen tepkime vermeyen taneciklerin çarpışmasına etkin olmayan çarpışma denir.
OluÅŸacak moleküllerin geometrik düzeni ve elektron dağılımı çarpışmaların belli bir geometrik doÄŸrultusunda çarpışmasını gerektirir. Uygun geometrik doÄŸrultuda çarpışmayan moleküller tepkime veremez.
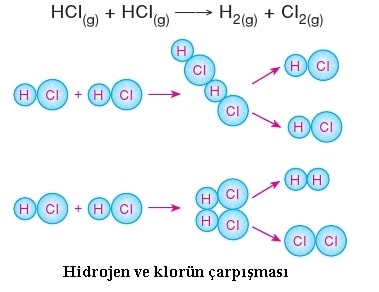
- Taneciklerin çarpışması,
- Çarpışmaların etkin çarpışma (enerjisi yeterli) olması,
- Taneciklerin uygun geometrik doÄŸrultuda çarpışması gerekir.
AktifleÅŸme Enerjisi
Karışım halinde olan H2 ve O2 tepkime vermez. Bir dış etki olmadıkça hidrojen ve oksijen karışımı patlamaz, patlama için bir kıvılcım, bir alev ya da ısı gereklidir. Odun, kömür, mum, kağıt gibi maddeler havada uzun süre deÄŸiÅŸmeden durabilir. TutuÅŸmaları için, sıcaklık, alev, sürtünme ya da ısı gerekir.
Bir tepkimenin baÅŸlayabilmesi için gerekli olan en düÅŸük enerji miktarına aktifleÅŸme enerjisi veya eÅŸik enerjisi denir.
Bu bir enerji engelidir. Bu enerji engelini aÅŸan ve uygun geometrik doÄŸrultuda çarpışan tanecikler arasında tepkime gerçekleÅŸebilir.
Taneciklerin çarpışarak ürüne dönüÅŸebilmeleri için gerekli olan minimum enerji, bir diÄŸer ifade ile aktifleÅŸme enerjisi küçük ise fazla molekülün kinetik enerjisi bu engeli aÅŸar ve tepkime hızlı gerçekleÅŸir.
AktifleÅŸme enerjisi yüksek ise çok az molekülün kinetik enerjisi bu enerji engelini aÅŸabilir ve tepkime yavaÅŸ gerçekleÅŸir.
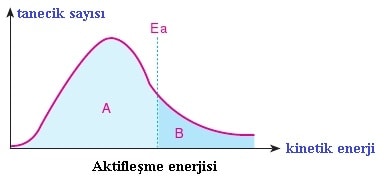
A bölgesinde bulunan tanecikler uygun geometrik doÄŸrultuda çarpışsalar bile tepkime gerçekleÅŸmez. Enerjileri aktifleÅŸme enerjisini aÅŸmamıştır.
B bölgesindeki taneciklerin kinetik enerjileri Ea barajını aÅŸtığı için bu taneciklerin uygun geometrik doÄŸrultuda çarpışması tepkime ile sonuçlanır.
- AktifleÅŸme (aktivasyon) enerjisine eÅŸik enerjisi de denir.
- AktifleÅŸme enerjisi Ea ile gösterilir. Eai = Ä°leri tepkimenin aktifleÅŸme enerjisi Eag = Geri tepkimenin aktifleÅŸme enerjisi
- AktifleÅŸme enerjisini basınç ve sıcaklık etkilemez.
- Aktifleşme enerjisini madde miktarı etkilemez.
- AktifleÅŸme enerjisini katalizör etkiler.
